Giải thích tại sao ở điều kiện thường, các nguyên tố nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn
Quảng cáo
Trả lời:
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
5 nguyên tử H liên kết với C không tham gia vào liên kết hydrogen do độ âm điện của C nhỏ (2,55)
Lời giải
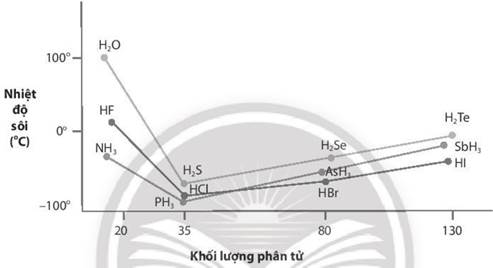
a) Các nguyên tố đầu tiên trong mỗi nhóm VA, VIA, VIIA (N, O, F) có kích thước nhỏ và độ âm điện lớn, nên trong các chất NH3; H2O; HF xuất hiện liên kết hydrogen liên phân tử làm các hợp chất này có nhiệt độ sôi cao bất so với các hợp chất cong lại trong mỗi nhóm.
b) Hợp chất với hydrogen của các nguyên tố còn lại trong mỗi nhóm có nhiệt độ sôi tăng dần khi khối lượng phân tử tăng. Khi khối lượng phân tử tăng làm cho tương tác van der Waals cũng tăng, dẫn đến nhiệt độ sôi tăng lênLời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.