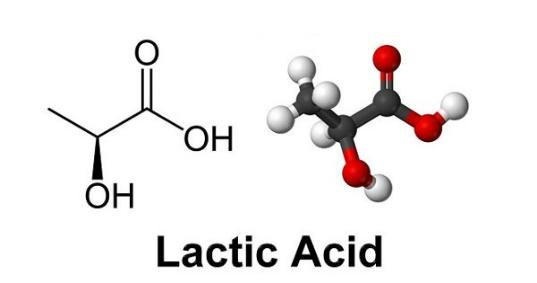
Cho các phương trình nhiệt hóa học của phản ứng:
a) 3H2(g) + 3/2O2(g)  3H2O(l)
3H2O(l) 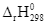 = –857,52 kJ
= –857,52 kJ
b) 2S(s) + 3O2(g)  2SO3(g)
2SO3(g) 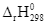 = +792,2 kJ
= +792,2 kJ
Ở điều kiện chuẩn nếu đốt cháy hoàn toàn 1,2 gam H2 (a) và 3,2 gam S (b) thì lượng nhiệt tỏa ra hay cần cung cấp là bao nhiêu?
Cho các phương trình nhiệt hóa học của phản ứng:
a) 3H2(g) + 3/2O2(g) ![]() 3H2O(l)
3H2O(l) ![]() = –857,52 kJ
= –857,52 kJ
b) 2S(s) + 3O2(g) ![]() 2SO3(g)
2SO3(g) ![]() = +792,2 kJ
= +792,2 kJ
Ở điều kiện chuẩn nếu đốt cháy hoàn toàn 1,2 gam H2 (a) và 3,2 gam S (b) thì lượng nhiệt tỏa ra hay cần cung cấp là bao nhiêu?
Quảng cáo
Trả lời:
- ![]() , lượng nhiệt tỏa ra phản ứng (a): (857,52.0,3)/3 = 171,504 kJ
, lượng nhiệt tỏa ra phản ứng (a): (857,52.0,3)/3 = 171,504 kJ
- ![]() , lượng nhiệt tỏa ra phản ứng (b): (792,2.0,1)/2 = 39,61 kJ
, lượng nhiệt tỏa ra phản ứng (b): (792,2.0,1)/2 = 39,61 kJ
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.