Đốt cháy hoàn toàn 6,2 gam phosphorus trong khí oxygen. Hãy tính thể tích khí oxygen (đkc) và khối lượng sản phẩm tạo thành theo phản ứng:
4P + 5O2 → 2P2O5.
Quảng cáo
Trả lời:
Phương trình hoá học: 4P + 5O2 → 2P2O5
Tỉ lệ các chất: 4 : 5 : 2
Số mol phosphorus đã bị đốt cháy: \[{n_P} = \frac{{6,2}}{{31}} = 0,2(mol)\]
Theo tỉ lệ mol của phản ứng, ta có:
\[\begin{array}{l}{n_{{O_2}}} = \frac{5}{4} \times {n_P} = \frac{5}{4} \times 0,2 = 0,25(mol) \Rightarrow {V_{{O_2}}} = 0,25 \times 24,79 = 6,1975(L);\\{n_{{P_2}{O_5}}} = \frac{1}{2} \times {n_P} = 0,1\,(mol) \Rightarrow {m_{{P_2}}}_{{O_5}} = 0,1 \times 142 = 14,2(gam).\end{array}\]
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. 13,0 gam.
B. 15,9 gam.
C. 19,5 gam.
D. 26,0 gam.
Lời giải
Đáp án đúng là: C
Số mol H2 thu được là: \({n_{{H_2}}} = \frac{{7,437}}{{24,79}} = 0,3(mol)\)
PTHH: Zn + 2HCl →ZnCl2 + H2
Tỉ lệ phản ứng: 1 1
Đề bài: 0,3 ← 0,3 (mol)
Vậy khối lượng của Zn là 0,3×65 = 19,5 gam.
Câu 2
A. 49,58 lít.
B. 74,37 lít.
C. 37,185 lít.
D. 14,874 lít.
Lời giải
Đáp án đúng là: D
Phương trình hoá học:
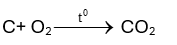
Theo bài ra, than đá có chứa 96% carbon.
Khối lượng cacbon là 7,5.96% = 7,2 gam \[{n_C} = \frac{{7,2}}{{12}}\]= 0,6 mol
Theo PTHH: \[{n_{{O_2}}}\] = \[{n_C}\] = 0,6 mol
Thể tích khí oxygen ở điều kiện chuẩn (tại 25oC và 1 bar) vừa đủ cần dùng là:
\[{v_{{O_2}}}\]= 0,6.24,79 = 14,874 lít.
Câu 3
A. 3,72 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 1,12 lít.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. 0,1 mol.
B. 1 mol.
C. 0,2 mol.
D. 0,3 mol.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 2,4 gam.
B. 12 gam.
C. 2,3 gam.
D. 7,2 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. 2,2400 lít.
B. 2,4790 lít.
C. 1,2395 lít.
D. 4,5980 lít.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.