Cho phương trình nhiệt hóa học sau:
N2(g) + O2(g)  2NO(g)
2NO(g)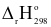 = +179,20 kJ
= +179,20 kJ
(a) Phản ứng trên là phản ứng thu nhiệt.
(b) Enthalpy tạo thành chuẩn của N2 (g) và O2 (g) bằng 0.
(c) Tổng enthalpy tạo thành của các chất tham gia phản ứng trên nhỏ hơn tổng enthalpy tạo thành của chất sản phẩm.
(d) Để đốt cháy 2 mol N2 cần cung cấp nhiệt lượng là 179,2 kJ.
Câu hỏi trong đề: Bài tập ôn tập Hóa 10 Kết nối tri thức Chương 5 có đáp án !!
Quảng cáo
Trả lời:
(a) Đúng. Do phản ứng có 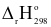 = +179,20 kJ > 0.
= +179,20 kJ > 0.
(b) Đúng. Enthalpy tạo thành chuẩn của các đơn chất ở trạng thái bền vững nhất = 0.
(c) Đúng.
(d) Sai. Để đốt cháy 1 mol N2 cần cung cấp nhiệt lượng là 179,2 kJ.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
(a) Đúng. Do 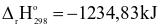 < 0.
< 0.
(b) Đúng. Do nhiệt tạo thành của các đơn chất ở trạng thái bền vững nhất là = 0.
(c) Sai. 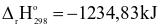 < 0nên tổng enthalpy tạo thành của các chất tham gia phản ứng trên lớn hơn tổng enthalpy của sản phẩm.
< 0nên tổng enthalpy tạo thành của các chất tham gia phản ứng trên lớn hơn tổng enthalpy của sản phẩm.
(d) Sai. Để đốt cháy 1 mol chất lỏng C2H5OH tỏa ra nhiệt lượng là 1234,83 kJ.
Câu 2
Cho enthalpy tạo thành chuẩn của một số chất như sau:
| Chất | TiCl4(g) | H2O(l) | TiO2(s) | HCl(g) |
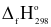 (kJ/mol) (kJ/mol)
| -763 | -286 | -945 | -92 |
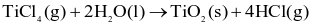 là
là
+3 kJ.
+22 kJ.
−22 kJ.
−3229 kJ.
Lời giải
Đáp án đúng là: B
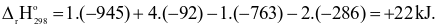
Câu 3
NaCl(s).
CO2(g).
H2O(l).
H2(g).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
 2CO2(g) + 3H2O(g)
2CO2(g) + 3H2O(g) 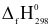 ) bằng 0 (kJ/mol)?
) bằng 0 (kJ/mol)?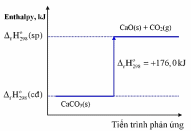
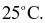
 2NO(g)
2NO(g)