Trong dung dịch, amino acid tồn tại ở dạng ion lưỡng cực, cation hay anion tùy thuộc vào pH của dung dịch. Giá trị pH mà tại đó nồng độ dạng ion lưỡng cực đạt giá trị lớn nhất gọi là điểm đẳng điện (ký hiệu là pI). Điểm đẳng điện của các amino acid được tính theo biểu thức: .
(với Ka1, Ka2 là hằng số phân li acid của các nhóm chức; pKa = -logKa)
Đối với các diamino monocarboxylic hoặc monoamino dicarboxylic, pI là giá trị trung bình của hai giá trị pKa gần nhau. Cho pKa của các amino acid như sau:
| Amino acid | pKa1 | pKa2 | pKa3 |
| Alanine | 2,35 | 9,87 | |
| Lysine | 2,18 | 8,95 | 10,53 |
| Aspartic acid | 2,10 | 3,86 | 9,82 |
(a). Tính điểm đẳng điện của alanine, lysine, aspartic acid.
(b). Viết công thức dạng ion lưỡng cực của các amino acid alanine, lysine, aspartic acid tại điểm đẳng điện.
(c). Viết công thức các dạng ion chủ yếu của từng amino acid trong dung dịch ở pH = 1 và ở pH = 13.
(d). Các amino acid có các điểm đẳng điện khác nhau nên ở một pH xác định, chúng sẽ di chuyển về cathode hoặc anode với những vận tốc khác nhau. Dựa trên cơ sở này người ta xây dựng phương pháp điện di để phân tích và tinh chế các amino acid từ hỗn hợp của chúng. Tính các dạng tồn tại chủ yếu của alanine và aspartic acid ở pH = 5,97. Từ đó cho biết có thể tách được 2 amino acid này bằng phương pháp điện di ở không?
Câu hỏi trong đề: Đề ôn thi Hóa học ĐGNL ĐHSP Hà Nội có đáp án !!
Quảng cáo
Trả lời:
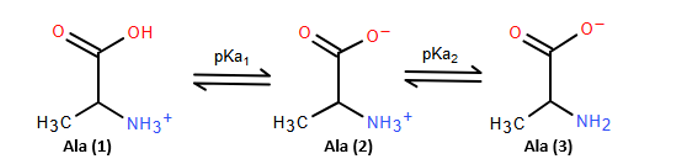
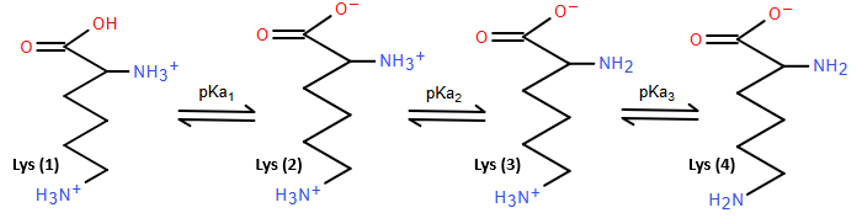
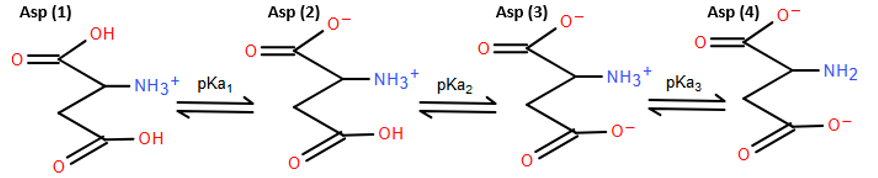
a). Dạng ion lưỡng cực Ala (2) nằm giữa pKa1 và pKa2 nên Ala có:
Dạng ion lưỡng cực Lys (3) nằm giữa pKa2 và pKa3 nên Lys có:
.
Dạng ion lưỡng cực Asp (2) nằm giữa pKa1 và pKa2 nên Asp có:
b). Công thức dạng ion lưỡng cực tại điểm đẳng điện: Dạng Ala (2), Lys (3) và Asp (2) trong hình trên.
c). Ở pH = 1, dạng ion chủ yếu là Ala (1), Lys (1) và Asp (1).
Ở pH = 13, dạng ion chủ yếu là Ala (3), Lys (4) và Asp (4).
d). Ở pH = 5,97 ≈ pI của Ala nên Ala tồn tại chủ yếu ở dạng Ala (2) và không bị di chuyển trong điện trường.
pH = 5,97 > pI của Asp nên Asp tồn tại chủ yếu ở các dạng mang điện âm (Asp (3) và Asp (4)) và di chuyển về phía cực dương trong điện trường.
Vậy có thể tách Ala và Asp bằng phương pháp điện di ở pH = 5,97.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: A
Các phát biểu (1) và (2) đúng.
Phát biểu (3) sai, đốt cháy rác thải nhựa gây ô nhiễm môi trường vì phát sinh nhiều khí thải và tro, bụi.
Phát biểu (4) sai, tơ tằm có thành phần chính là protein, chúng kém bền với nhiệt, môi trường kiềm.
Phát biểu (5) sai, keo dán epoxy có thành phần chính là chất hữu cơ có 2 nhóm epoxy ở hai đầu.
Câu 2
Màu xanh lam của dung dịch CuSO4 nhạt dần.
Kim loại màu đỏ được sinh ra bám vào cathode.
Có khí không màu (O2) thoát ra ở anode.
Thấy có khí thoát ra ở 2 điện cực.
Lời giải
Đáp án đúng là: D
- Phát biểu A đúng, màu xanh của dung dịch do Cu2+ gây ra, nồng độ ion này giảm dần nên màu xanh cũng nhạt dần.
- Phát biểu B đúng, tại cathode tạo Cu màu đỏ: Cu2+ + 2e → Cu.
- Phát biểu C đúng, tại anode: 2H2O → O2 + 4H+ + 4e.
- Phát biểu D sai, nên Cu2+ vẫn còn dư, chưa có khí thoát ra tại cathode.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
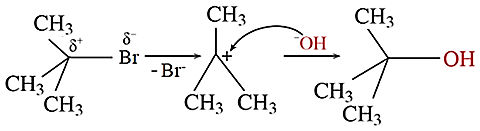
Phản ứng thuỷ phân 2-bromo-2-methylpropane là phản ứng tách hydrogen halide.
Trong giai đoạn (1) do độ âm điện C lớn hơn Br nên liên kết phân cực về phía Br.
Trong giai đoạn (2) có sự hình thành liên kết σ.
Sản phẩm thu được sau phản ứng thủy phân là alcohol bậc IV.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
a. Khi chuẩn độ, dung dịch KMnO₄ được nhỏ trực tiếp vào bình tam giác từ dụng cụ kí hiệu là (B) được minh họa ở Hình 1.
b. Giá trị của q là 7,9. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần mười.)
c. Giá trị của C2 là 0,109. (Kết quả các phép tính trung gian không được làm tròn, chỉ kết quả cuối cùng được làm tròn đến hàng phần nghìn.)
d. Kết quả thu được từ các thí nghiệm phù hợp với giả thuyết ban đầu của nhóm học sinh.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Sau bước 1, trong bình cầu có phản ứng ester hóa sau: CH3COOH + HOCH2CH3 CH3COOCH2CH3 + H2O
B. Ở bước 3, dung dịch NaCl bão hòa có vai trò làm tăng hiệu suất phản ứng ester hóa.
C. Sau bước 2, các chất C2H5OH và CH3COOH vẫn còn trong bình cầu.
D. Đun nóng 6 gam acetic acid với 6 gam ethyl alcohol có H2SO4 đặc làm xúc tác. Khối lượng ester tạo thành khi hiệu suất phản ứng 80% là 8,8 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
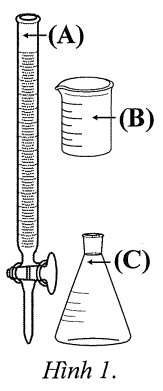 Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10⁻2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.
Bước 2: Chuẩn độ dung dịch trong bình tam giác bằng dung dịch KMnO4 2,20×10⁻2 M đến khi xuất hiện màu hồng nhạt (bền trong khoảng 20 giây) thì dừng. Ghi lại thể tích dung dịch KMnO4 đã dùng.