Một hỗn hợp N2 và H2 được lấy vào bình phản ứng có nhiệt độ được giữ không đổi. Sau một thời gian phản ứng, áp suất của các khí trong bình giảm 10% so với áp suất ban đầu. Biết rằng tỉ lệ số mol N2 đã phản ứng là 10%. Tính thành phần phần trăm số mol N2 trong hỗn hợp đầu?
A. 50%
B. 49%
C. 47%
D. 48%
Câu hỏi trong đề: Bài tập Nito - Photpho có lời giải chi tiết !!
Quảng cáo
Trả lời:
A.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Hóa học 11 dùng cho cả 3 bộ sách Kết nối, Cánh diều, Chân trời sáng tạo VietJack - Sách 2025 ( 58.000₫ )
- Trọng tâm Sử, Địa, GD KTPL 11 cho cả 3 bộ Kết nối, Chân trời, Cánh diều VietJack - Sách 2025 ( 38.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Chọn đáp án D
Ta có:
Áp dụng phương pháp đường chéo cho hỗn hợp X:
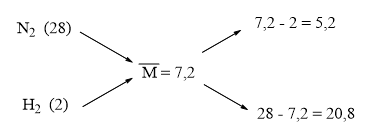
⇒ ⇒ Hiệu suất tính theo N2.
Gọi ⇒
⇒ nhh X = x + 4x = 5x (mol)
Phương trình hóa học:
N2 + 3H2 2NH3
Gọi a là số mol N2 phản ứng
⇒ phản ứng = 3a (mol);
⇒ nhh Y = (x – a) + (4x – 3a) + 2a = 5x – 2a (mol)
Mà mX = mY ⇒
⇒
⇒ a = 0,25x (mol)
Hiệu suất phản ứng: H =
Câu 2
A. 8 lít
B. 2 lít
C. 4 lít
D. 1 lít
Lời giải
Đáp án C
Câu 3
A. 16 lít
B. 20 lít
C. 6 lít
D. 10 lít
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. % = 25%; % = 75%
B. % = 30%; % = 70%
C. % = 22,5%; % = 77,5%
D. % = 20%; % = 80%
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.