Cho phản ứng của sắt (Fe) với oxi (O2) như hình vẽ bên:
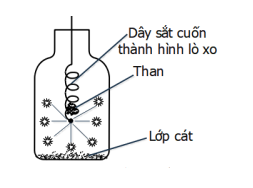
Cho các phát biểu sau:
(1) Sản phẩm của phản ứng là Fe2O3.
(2) Khi đưa vào lọ chứa oxi, dây thép cháy trong oxi sáng chói, nhiều hạt nhỏ sáng bắn tóe như pháo hoa.
(3) Nước trong bình có vai trò là chất xúc tác để cho phản ứng xảy ra nhanh hơn.
(4) Mẩu than gỗ có tác dụng làm mồi vì khi than cháy, tỏa nhiệt lượng đủ lớn để phản ứng giữa Fe và O2 xảy ra (có thể thay mẩu than bằng que diêm).
(5). Cần làm sạch và uốn sợi dây thép thành hình lò xo để tăng diện tích tiếp xúc, phản ứng xảy ra nhanh hơn.
Số phát biểu đúng là
Cho phản ứng của sắt (Fe) với oxi (O2) như hình vẽ bên:

Cho các phát biểu sau:
(1) Sản phẩm của phản ứng là Fe2O3.
(2) Khi đưa vào lọ chứa oxi, dây thép cháy trong oxi sáng chói, nhiều hạt nhỏ sáng bắn tóe như pháo hoa.
(3) Nước trong bình có vai trò là chất xúc tác để cho phản ứng xảy ra nhanh hơn.
(4) Mẩu than gỗ có tác dụng làm mồi vì khi than cháy, tỏa nhiệt lượng đủ lớn để phản ứng giữa Fe và O2 xảy ra (có thể thay mẩu than bằng que diêm).
(5). Cần làm sạch và uốn sợi dây thép thành hình lò xo để tăng diện tích tiếp xúc, phản ứng xảy ra nhanh hơn.
Số phát biểu đúng là
A. 5.
Quảng cáo
Trả lời:
Đáp án D
Phương pháp giải:
Dựa vào lý thuyết tổng hợp về thí nghiệm phản ứng đốt cháy sắt trong oxi.
Giải chi tiết:
(1) sai vì sản phẩm của phản ứng là Fe3O4.
PTHH: 3Fe + 2O2 Fe3O4.
(3) sai vì nước trong bình có vai trò tránh vỡ bình vì phản ứng tỏa nhiều nhiệt.
(2), (4), (5) đúng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án D
Phương pháp giải:
* Xét phản ứng: Zn + FeSO4 → ZnSO4 + Fe
So sánh nZn và nFeSO4 ⟹ chất dư, hết ⟹ Thành phần của X.
* Xét phản ứng: X + HCl → muối + H2
Theo PTHH ⟹ nH2 ⟹ V.
Giải chi tiết:
* Xét phản ứng cho Zn vào dung dịch FeSO4
PTHH: Zn + FeSO4 → ZnSO4 + Fe
0,25 0,2 (mol)
⟹ Sau phản ứng, FeSO4 phản ứng hết và Zn còn dư.
Theo PTHH ⟹ nZn(pứ) = nFe = nFeSO4 = 0,2 (mol)
⟹ nZn(dư) = 0,25 – 0,2 = 0,05 (mol)
Vậy trong X gồm Zn dư 0,05 (mol) và Fe 0,2 (mol).
* Xét phản ứng hòa tan X bằng dung dịch HCl
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nH2 = nZn + nFe = 0,25 (mol)
Vậy V = 0,25.22,4 = 5,6 (lít).
Câu 2
A. 28,0%.
Lời giải
Đáp án B
Phương pháp giải:
PTHH: Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nFe ⟹ mFe ⟹ mCu ⟹ %mCu.
Giải chi tiết:
PTHH: Fe + 2HCl → FeCl2 + H2
Theo PTHH ⟹ nFe = nH2 = 1,12/22,4 = 0,05 (mol).
⟹ mCu = mX – mFe = 5 – 0,05.56 = 2,2 (g).
Vậy %mCu = (2,2.100%)/5 = 44%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 1.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.