Làm lạnh 160 gam dung dịch bão hòa muối RSO430% xuống tới nhiệt độ 200C thì thấy có 28,552 gam tinh thể RSO4.nH2O tách ra. Biết độ tan của RSO4ở 20oC là 35 gam. Xác định công thức của tinh thể RSO4.nH2O biết R là kim loại; n là số nguyên và 5 < n < 9.
A. FeSO4.7H2O.
B. MgSO4.7H2O.
C.CuSO4.5H2O.
D.ZnSO4.2H2O.
Quảng cáo
Trả lời:
Bước 1:Tính \[{m_{RS{O_4}}}\] ban đầu, mddbão hòa
\[{m_{RSO4(bd)}} = \frac{{30}}{{100}}.160 = 48(gam)\]
- mdd bão hòa(sau khi kết tinh)= 160 - 28,552 = 131,478 gam
Bước 2:Tính mRSO4mRSO4 ở 20oC, mRSO4mRSO4 trong RSO4.nH2O bị kết tinh
- Ở 20oC: SRSO4= 35 gam, ta có:
mRSO4(dd 20oC)\[ = \frac{{35}}{{135}}.131,478 = 34,087gam\]
- Khối lượng RSO4trong RSO4.nH2O bị kết tinh là:
mRSO4 (kt)= mRSO4 (ban đầu)- mRSO4 (20 độ)= 48 - 34,087 = 13,913 gam
Bước 3:Biện luận tìm CTPT của muối ngậm nước
- Xét phân tử RSO4.nH2O ta có:
\[\frac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \frac{{R + 96}}{{18n}} = \frac{{13,913}}{{28,552 - 13,913}} \to R = 17,142n - 96\]
Biện luận:
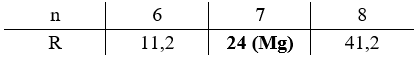
Vậy công thức của muối ngậm nước là MgSO4.7H2O.
Đáp án cần chọn là: B
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. 601,6 gam.
B. 606,4 gam.
C. 578,8 gam.
D. 624,4 gam.
Lời giải
Bước 1: Tính mH2Ovà mMgSO4để tạo thành 1642 gam dd bão hòa.
- Ở 800C, SMgSO4= 64,2 gam
- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòa
a gam H2O hòa tan b gam MgSO4tạo thành 1642 gam dung dịch bão hòa
→ a = 1642.100/164,2 = 1000 gam; b = 64,2.1642/164,2 = 642 gam
- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol
⟹ Khối lượng H2O tách ra: 108x (g)
Khối lượng MgSO4tách ra: 120x (gam)
Bước 3: Tính khối lượng tinh thể MgSO4.6H2O kết tinh
- Ở 200C, SMgSO4= 44,5 gam
- Ta có phương trình: \[\frac{{642 - 120x}}{{1000 - 108x}} = \frac{{44,5}}{{100}}\]
Giải ra x = 2,7386 mol
- Khối lượng MgSO4.6H2O kết tinh: 228.2,7386 = 624,4 gam.
Đáp án cần chọn là: D
Câu 2
A. 26,61 gam.
B. 23,31 gam.
C.28,62 gam.
D.19,33 gam.
Lời giải
Bước 1: Tính mH2SO4 và mH2Osau phản ứng
PTHH: MgO + H2SO4→ MgSO4+ H2O
0,25 → 0,25 0,25 0,25 mol
mH2SO4= 0,25.98 = 24,5 gam
→ Khối lượng nước sau phản ứng: \[{m_{H2O}} = \frac{{75}}{{25}}.24,5 + 0,25.18 = 78gam\]
Bước 2: Tính mMgSO4 còn lại và mH2O còn lại
- Gọi x là số mol MgSO4.7H2O kết tinh
→ mMgSO4 còn lại= mMgSO4 ban đầu- mMgSO4 tách ra= 0,25.120 - 120x = 30 - 120x (gam)
mH2O còn lại= mH2O ban đầu- mH2O tách ra= 78 - 7x.18 = 78 - 126x (gam)
Bước 3: Tính mMgSO4.7H2O
- Ta có phương trình độ tan của MgSO4ở 100C là:
\[S = \frac{{30 - 120x}}{{78 - 126x}} \times 100 = 28,2\] → x = 0,09476 mol
→ mMgSO4.7H2O= 0,09476.246 = 23,31 gam.
Đáp án cần chọn là: B
Câu 3
A. 26,25 gam.
B. 25,00 gam.
C.28,75 gam.
D.27,35 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. 213,2 gam.
B. 132,1 gam.
C. 321,1 gam.
D. 112,3 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. 62,50 gam và 437,50 gam.
B. 33,33 gam và 466,67 gam.
C. 37,50 gam và 462,50 gam.
D. 25,00 gam và 475,00 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 64 gam.
B. 88 gam.
C. 78 gam.
D. 42 gam.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.