Dựa vào năng lượng liên kết, tính ∆r các phản ứng sau:
a) Các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4, C2H6, H2 ở thể khí.
b) F2(g) + H2O(g) → 2HF(g) + O2(g)
Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
Dựa vào năng lượng liên kết, tính ∆r các phản ứng sau:
a) Các phản ứng đốt cháy hoàn toàn 1 mol mỗi chất C2H4, C2H6, H2 ở thể khí.
b) F2(g) + H2O(g) → 2HF(g) + O2(g)
Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
Quảng cáo
Trả lời:
a) C2H4(g) + 3O2(g) → 2CO2(g) + 2H2O(g)
∆r = 1 × Eb(C2H4) + 3 × Eb(O2) – 2 × Eb(CO2) – 2 × Eb(H2O)
∆r = 1 × (1EC=C + 4EC-H) + 3 × EO=O – 2 × 2EC=O – 2 × 2 × EO-H
∆r = 1 × (611 + 4 × 414) + 3 × 489 – 2 × 2× 736 – 2 × 2 × 464 = -1066 kJ < 0
⇒ Phản ứng này là thuận lợi
C2H6(g) + O2(g) → 2CO2(g) + 3H2O(g)
∆r = 1 × Eb(C2H6) + × Eb(O2) – 2 × Eb(CO2) – 3 × Eb(H2O)
∆r = 1 × (1EC-C + 6EC-H) + × Eb(O2) – 2 × 2EC=O – 3 × 2 × EO-H
∆r = 1 × (347 + 6 × 414) + × 498 – 2 × 2 × 736 – 3 × 2 × 464 = -1154 kJ < 0
⇒ Phản ứng này là thuận lợi
H2(g) + O2(g) → H2O(g)
∆r = 1 × Eb(H2) + × Eb(O2) – 1 × Eb(H2O)
∆r = 1 × EH-H + × Eb(O2) – 1 × 2 × EO-H
∆r = 1 × 436 + × 498 – 1 × 2 × 464 = -243 kJ < 0
⇒ Phản ứng này là thuận lợi
b) F2(g) + H2O(g) → 2HF(g) + O2(g)
∆r= 1 × E(F2) + 1 × E(H2O) - 2 × E(HF) - × E(O2)
∆r = 1 × EF-F + 1 × 2 × EO-H - 2 × EH-F - × E(O2)
∆r = 1 × 159 + 1 × 2 × 464 - 2 × 565 - × 498 = -292 kJ < 0
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
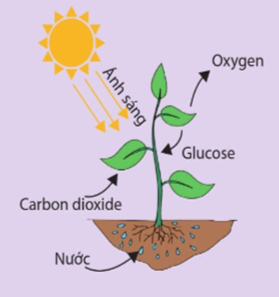
Để tạo thành 1 mol glucose C6H12O6(s) ta có
6CO2(g) + 6H2O(l) → C6H12O6(s) + 6O2(g)
∆r = 1 × ∆f(C6H12O6) + 6 × ∆f(O2) – 6 × ∆f(CO2) – 6 × ∆f(H2O)
∆r = 1 × (-1271,1) + 6 × 0 – 6 × (-393,5) – 6 × (-285,8) = 2804,7 kJ
Vậy cần phải cung cấp năng lượng là 2804,7 kJ dưới dạng ánh sáng cho những phản ứng quang hợp để tạo thành 1 mol glucose C6H12O6(s)Lời giải
Để đốt cháy 1 mol CH4(g) cần hấp thu 249,9 kJ nhiệt lượng
Vậy đốt cháy mol CH4(g) cần hấp thu 249,9. = 41,65 kJ nhiệt lượng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.