Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng:
Mg + 2H2O → Mg(OH)2 + H2↑
Chuẩn bị: Mg dạng phoi bào, dung dịch phenolphthalein, nước cất, 2 ống nghiệm, đèn cồn, kẹp gỗ.
Tiến hành:
- Cho vào mỗi ống nghiệm khoảng 3 mL nước cất.
- Nhỏ vào mỗi ống nghiệm 1 – 2 giọt phenolphthalein và cho vào mỗi ống 1 mẫu phoi bào Mg.
- Đun nóng 1 ống nghiệm.
Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí nghiệm.
Quan sát và trả lời câu hỏi:
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Nghiên cứu ảnh hưởng của nhiệt độ đến tốc độ phản ứng:
Mg + 2H2O → Mg(OH)2 + H2↑
Chuẩn bị: Mg dạng phoi bào, dung dịch phenolphthalein, nước cất, 2 ống nghiệm, đèn cồn, kẹp gỗ.
Tiến hành:
- Cho vào mỗi ống nghiệm khoảng 3 mL nước cất.
- Nhỏ vào mỗi ống nghiệm 1 – 2 giọt phenolphthalein và cho vào mỗi ống 1 mẫu phoi bào Mg.
- Đun nóng 1 ống nghiệm.
Lưu ý: Làm sạch bề mặt Mg trước khi tiến hành thí nghiệm.
Quan sát và trả lời câu hỏi:
1. Sự thay đổi màu sắc trong ống nghiệm nào nhanh hơn?
2. Nhiệt độ ảnh hưởng như thế nào đến tốc độ phản ứng?
Câu hỏi trong đề: Bài tập Tốc độ phản ứng có đáp án !!
Quảng cáo
Trả lời:
1. Ống nghiệm được đun nóng, màu của dung dịch chuyển sang màu hồng nhanh hơn.
2. Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Phương trình tốc độ của phản ứng: v = k.CX.CY
b) Tốc độ phản ứng tại thời điểm đầu là:
v = 2,5.10-4.0,02.0,03 = 1,5.10-7 (mol/(L.s))
- Tại thời điểm đã hết một nửa lượng X
⇒ Nồng độ X còn 0,01M và đã phản ứng 0,01M
⇒ Theo phương trình, nồng độ Y phản ứng là 0,01M
⇒ Tại thời điểm xét, nồng độ Y còn 0,03M – 0,01M = 0,02M
⇒ v = 2,5.10-4.0,01.0,02 = 5.10-8 (mol/(L.s))
Lời giải
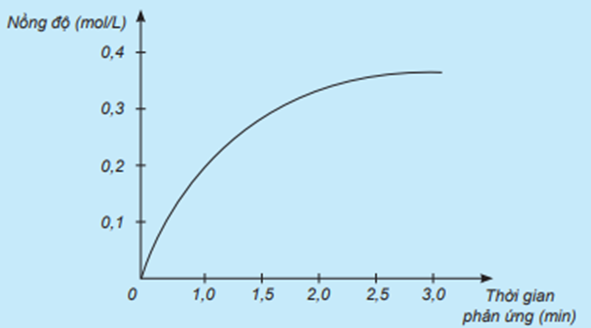
a) Đồ thị trên mô tả sự thay đổi nồng độ theo thời gian của HCl vì nồng độ của HCl tăng dần từ 0 mol/L theo thời gian.
b) Đơn vị của tốc độ phản ứng trong trường hợp này là mol/(L.min).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.