Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết.
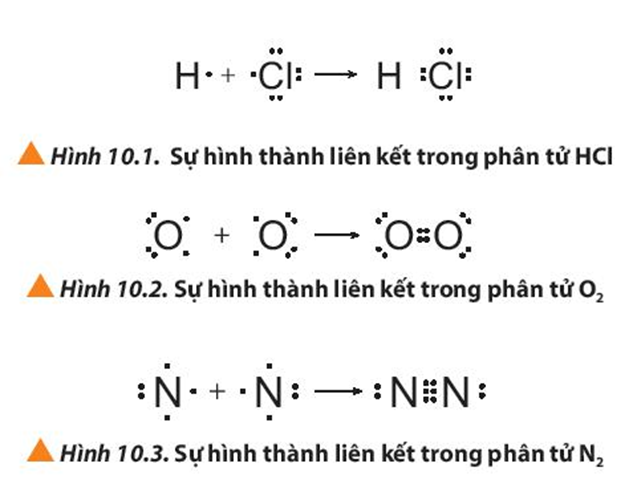
Quan sát các Hình 10.1 đến 10.3, cho biết quy tắc octet đã được áp dụng ra sao khi các nguyên tử tham gia hình thành liên kết.

Câu hỏi trong đề: Bài tập Liên kết cộng hóa trị có đáp án !!
Quảng cáo
Trả lời:
Các nguyên tử đã góp chung electron khi tham gia hình thành liên kết để mỗi nguyên tử đều đạt được cấu hình electron bền vững giống khí hiếm với 8 electron lớp ngoài cùng.(hoặc 2 electron ở lớp ngoài cùng giống khí hiếm helium).
- Để tạo thành liên kết trong phân tử HCl: Nguyên tử H và Cl, mỗi nguyên tử góp chung 1 electron tạo thành 1 cặp electron dùng chung. Khi đó H đạt được cấu hình electron của khí hiếm He với 2 electron lớp ngoài cùng. Cl đạt được cấu hình electron của khí hiếm Ar với 8 electron lớp ngoài cùng.
- Để tạo thành liên kết trong phân tử O2: Mỗi nguyên tử O góp chung 2 electron tạo thành 2 cặp electron dùng chung. Khi đó mỗi nguyên tử O đều đạt được cấu hình electron của khí hiếm Ne với 8 electron lớp ngoài cùng.
- Để tạo thành liên kết trong phân tử N2: Mỗi nguyên tử N góp chung 3 electron tạo thành 3 cặp electron dùng chung. Khi đó mỗi nguyên tử N đều đạt được cấu hình electron của khí hiếm Ne với 8 electron lớp ngoài cùng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
- Liên kết đơn gồm 1 liên kết σ.
- Liên kết đôi gồm 1 liên kết σ và 1 liên kết π.
- Liên kết ba gồm 1 liên kết σ và hai liên kết π.Lời giải
- Phân tử C2H2 gồm:
+ Hai liên kết đơn C-H. Hai liên kết này đều là liên kết σ.
+ Một liên kết ba C≡C gồm 1 liên kết σ và 2 liên kết π
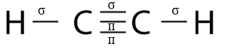
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.