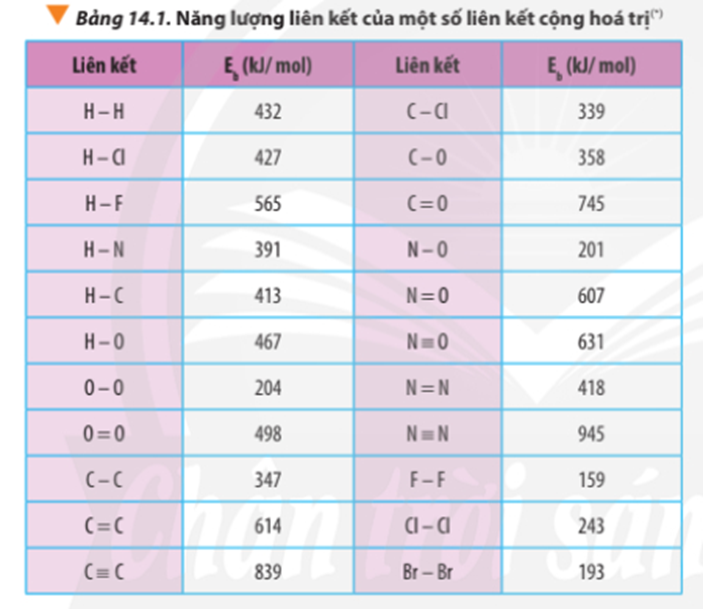
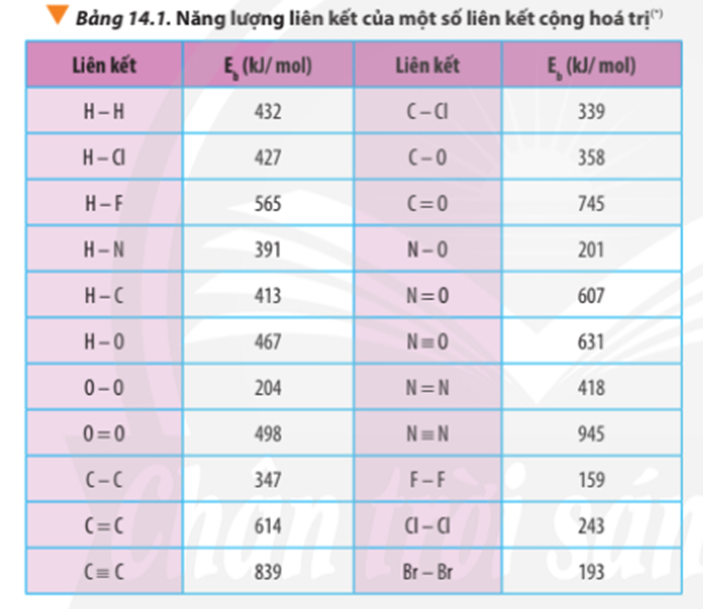
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

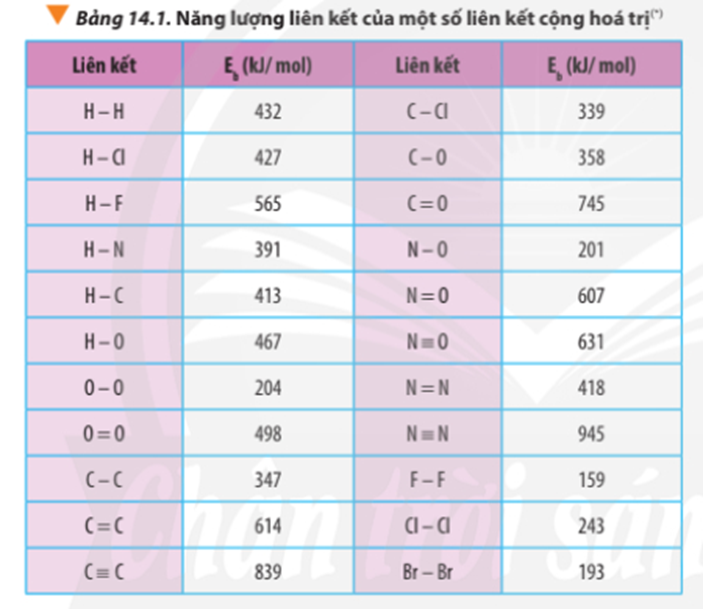
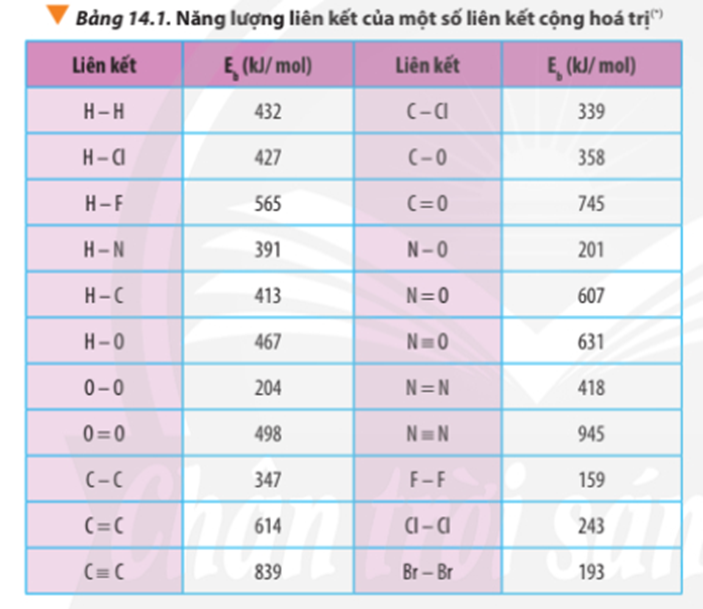
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)


Quảng cáo
Trả lời:
2H2(g) + O2(g) 2H2O(g) (1)
∆ r(1) = 2.Eb(H2) + Eb(O2) – 2.Eb(H2O)
∆ r(1) = 2.Eb(H-H) + Eb(O=O) – 2.2.Eb(O-H)
∆ r(1) = 2.432 + 498 – 2.2.467 = -506 kJ
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
∆ r(2) = Eb(C7H16) + 11.Eb(O2) – 7.Eb(CO2) – 8.Eb(H2O)
∆ r(2) = 6.Eb(C-C) + 16Eb(C-H) + 11.Eb(O=O) – 7.2.Eb(C=O) – 8.2.Eb(O-H)
∆ r(2) = 6.347 + 16.413 + 11.498 – 7.2.745 – 8.2.467 = -3734 kJ
Ta thấy: ∆ r(2) < ∆ r(1)
Tuy nhiên có còn có
Nếu lấy cùng khối lượng nhiên liệu chứng tỏ hydrogen là một loại khí có nhiệt cháy rất cao.
Thực tế hydrogen là một loại khí có nhiệt cháy cao nhất trong tất cả các nhiên liệu trong thiên nhiên, đã được sử dụng làm nhiên liệu phóng các tàu vũ trụ. Hydrogen là nguồn nhiên liệu an toàn, không gây sự cố cho môi trường, sản phẩm cháy chỉ là nước, được gọi là nhiên liệu sạch, lý tưởng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) 74,6 g SO2 tương ứng với mol SO2
Đốt cháy hoàn toàn 1 mol SO2(g) sinh ra 98,5 kJ nhiệt lượng
⇒ Đốt cháy hoàn toàn mol SO2(g) sinh ra 98,5. = 114,81 kJ nhiệt lượng
b) Lượng nhiệt giải phóng ra khi chuyển 1 mol SO2 thành 1 mol SO3 là 98,5 kJ
⇒ Lượng nhiệt cần cung cấp để phân hủy 1 mol SO3 cũng là 98,5 kJ
⇒ Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là +98,5 kJ.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.