Bài tập Cấu trúc lớp vỏ electron nguyên tử có đáp án
32 người thi tuần này 4.6 1.5 K lượt thi 12 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
- Trong nguyên tử, các electron chuyển động rất nhanh, không theo quỹ đạo xác định.
- Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo nguyên lí vững bền, nguyên lí Pauli và quy tắc Hund.
Lời giải
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định.
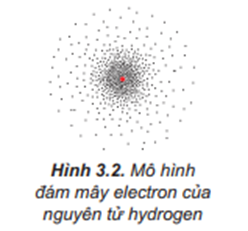
Lời giải
Đáp án C
Các orbital s có dạng hình cầu.
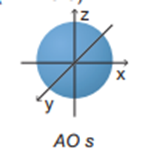
Lời giải
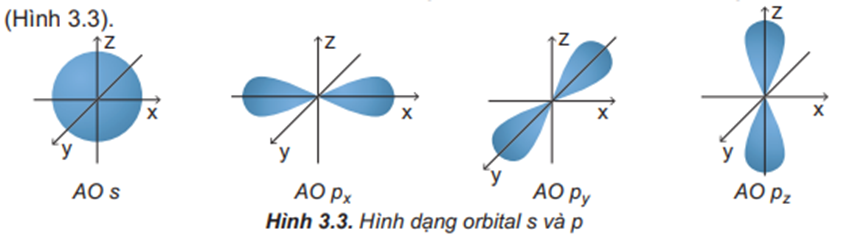
- Orbital p có dạng hình số 8 nổi và có 3 sự định hướng:
+ Orbital px định hướng theo trục x.
+ Orbital py định hướng theo trục y.
+ Orbital pz định hướng theo trục z.
Lời giải
a) Tổng số electron tối đa chứa trong phân lớp p là 6.
b) Tổng số electron tối đa chứa trong phân lớp d là 10.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.