Câu hỏi:
13/07/2024 14,173
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
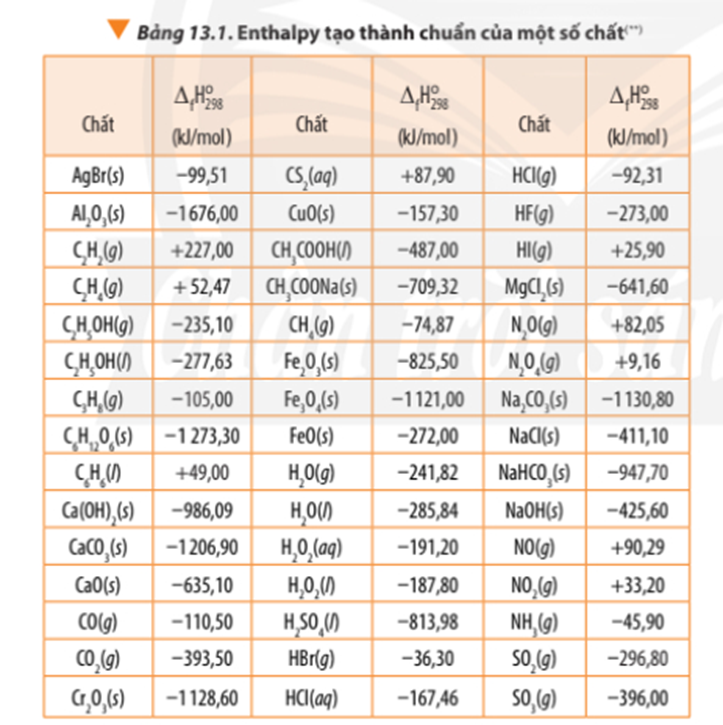
Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).

Sale Tết giảm 50% 2k7: Bộ 20 đề minh họa Toán, Lí, Hóa, Văn, Sử, Địa…. form chuẩn 2025 của Bộ giáo dục (chỉ từ 49k/cuốn).
Sách đề toán-lý-hóa Sách văn-sử-địa Tiếng anh & các môn khác
Quảng cáo
Trả lời:
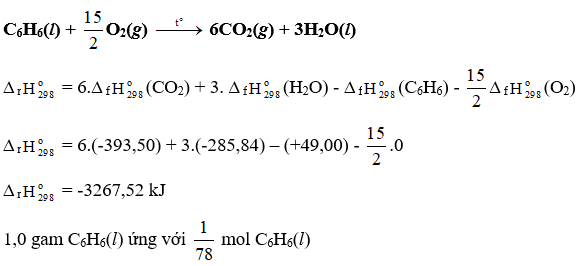
Đốt cháy 1 mol C6H6(l) tỏa ra 3267,52 kJ nhiệt lượng
⇒ Đốt cháy mol C6H6(l) tỏa ra là .3267,52 = 41,89 kJ nhiệt lượng
∆ r = 3.∆ f (CO2) + 4. ∆ f (H2O) - ∆ f (C3H8) – 5.∆ f (O2)
∆ r = 3.(-393,50) + 4.(-241,82) – (-105,00) - 5.0
∆ r = -2042,78 kJ
1,0 gam C3H8(g) ứng với mol C3H8(g)
Đốt cháy 1 mol C3H8(g) tỏa ra 2042, 78 kJ nhiệt lượng
⇒ Đốt cháy mol C3H8(g) tỏa ra là .2042, 78= 46, 42 kJ nhiệt lượng
Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) nhiều hơn khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).
Nhà sách VIETJACK:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
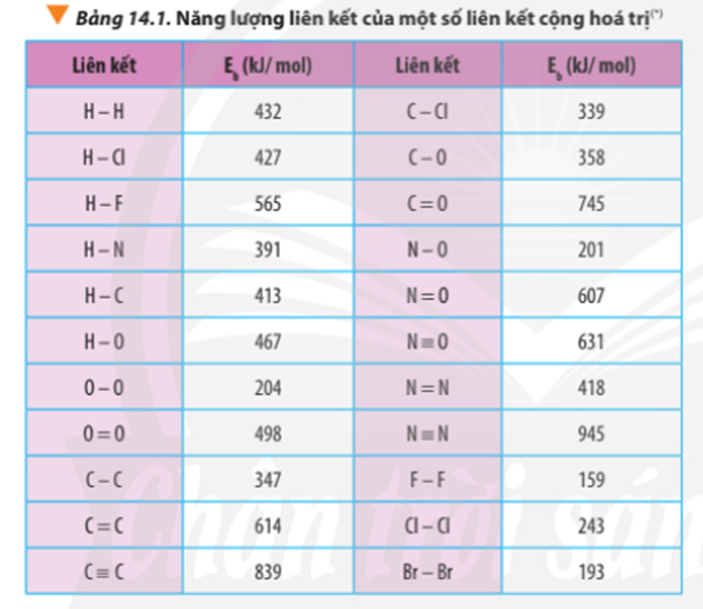
Tính ∆ r của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)

Tính ∆ r của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g)

Câu 2:
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g) ∆ r = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau:
2H2(g) + O2(g) → 2H2O(g) ∆ r = -483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Câu 3:
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)

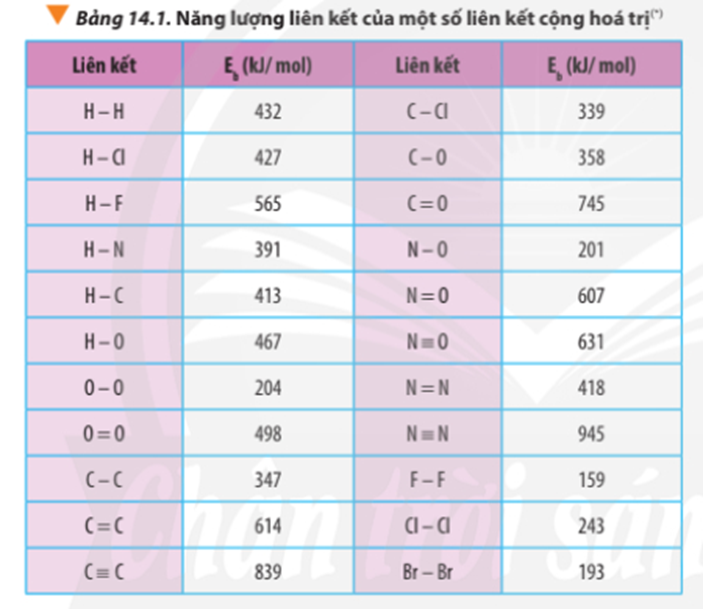
Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau:
2H2(g) + O2(g) 2H2O(g) (1)
C7H16(g) + 11O2(g) 7CO2(g) + 8H2O(g) (2)
So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H)


Câu 4:
Cho phương trình nhiệt hóa học sau:
SO2(g) + O2(g) SO3(g) ∆ r = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là bao nhiêu?
Cho phương trình nhiệt hóa học sau:
SO2(g) + O2(g) SO3(g) ∆ r = -98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆ r của phản ứng: SO3(g) → SO2(g) + O2(g) là bao nhiêu?
Câu 5:
Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?
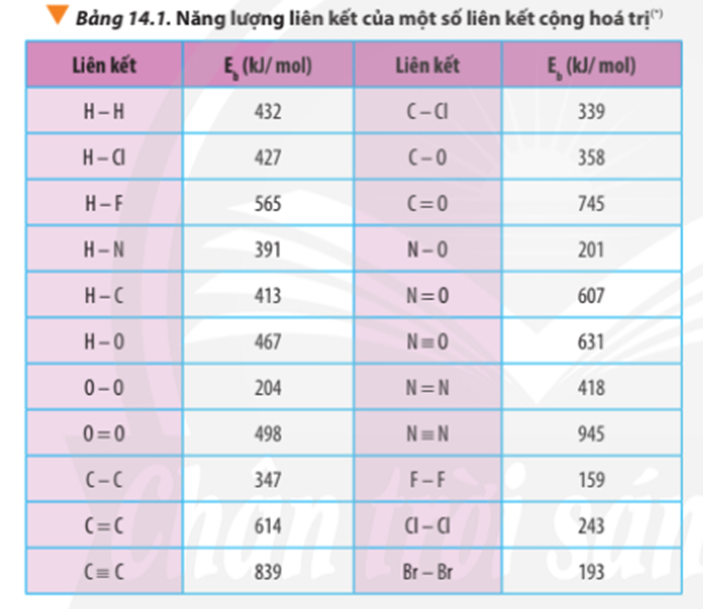
Xác định ∆ r của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1:
CH4(g) + Cl2(g) CH3Cl(g) + HCl(g)
Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt?

Câu 6:
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 2NO(g)
Bình luận
🔥 Đề thi HOT:
-
35 Bài tập Cấu tạo nguyên tử nâng cao cực hay có lời giải (P2)
-
10 Bài tập về phản ứng oxi hóa - khử (có lời giải)
-
Đề kiểm tra giữa học kì 1 Hóa học 10 Kết nối tri thức có đáp án- Đề 1
-
42 Bài tập Câu hỏi lí thuyết Liên kết hóa học (có lời giải)
-
40 Bài tập Câu hỏi lí thuyết Phản ứng oxi hóa - khử (có lời giải)
-
37 câu Trắc nghiệm Hóa 10 Cánh diều Chủ đề 1: Cấu tạo nguyên tử
-
15 câu Trắc nghiệm Hóa 10 Kết nối tri thức Biến thiên enthapy trong các phản ứng hóa học có đáp án
-
Bộ 2 Đề kiểm tra kì 2 Hóa học 10 Chân trời sáng tạo có đáp án - Đề 1

về câu hỏi!