a) Liệt kê một số đồ vật được mạ kim loại và nêu tác dụng của việc mạ đó.
b) Kể tên một số kim loại được sản xuất bằng phương pháp điện phân.
a) Liệt kê một số đồ vật được mạ kim loại và nêu tác dụng của việc mạ đó.
b) Kể tên một số kim loại được sản xuất bằng phương pháp điện phân.
Câu hỏi trong đề: Giải SGK Hoá học 12 Cánh Diều Bài 16: Điện phân có đáp án !!
Quảng cáo
Trả lời:
a) Một số đồ vật được mạ kim loại: chìa khoá; đồ trang sức; chảo; nồi …
Tác dụng của việc mạ kim loại: tăng độ bền, chống ăn mòn kim loại và cải thiện tính thẩm mĩ…
b) Một số kim loại được sản xuất bằng phương pháp điện phân:
+ Một số kim loại hoạt động trung bình và yếu: Cu, Fe… được điều chế bằng phương pháp điện phân dung dịch.
+ Các kim loại mạnh như: Na, K, Ca, Mg, Al … được sản xuất bằng phương pháp điện phân nóng chảy.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
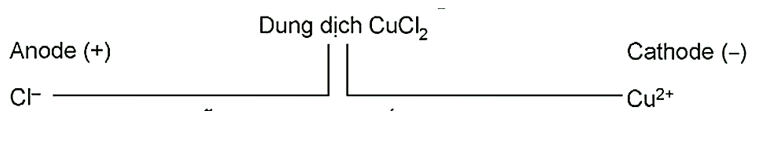
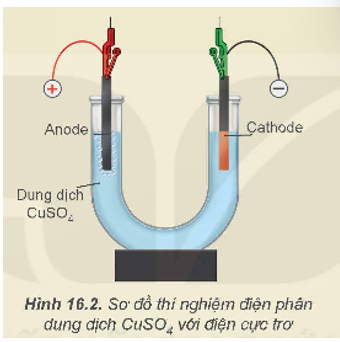
Tại anode (cực dương):
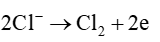
Tại cathode (cực âm):
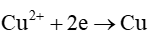
Phương trình hoá học của phản ứng điện phân:
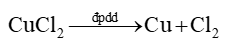
Lời giải
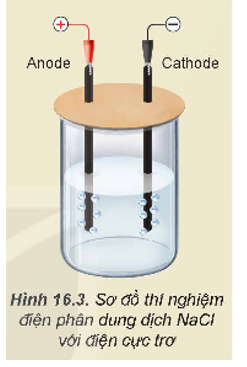
1. Hiện tượng: Ở hai điện cực đều có khí thoát ra.
Giải thích:
Quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực:
Tại anode:
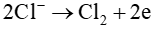
Tại cathode:
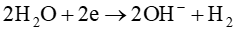
2. Dung dịch sau điện phân có tính tẩy màu, do không có màng ngăn giữa 2 cực nên sản phẩm tạo thành ở hai điện cực khuếch tán vào nhau sẽ xảy ra phản ứng hoá học tạo thành nước Javel:
Cl2 + 2NaOH → NaCl + NaClO + H2O
NaClO có tính oxi hoá mạnh, có khả năng phá huỷ các hợp chất màu (tính tẩy màu).
3. Nên dùng nắp đậy trong quá trình điện phân để tăng hiệu suất điều chế nước Javel, đồng thời hạn chế sự thoát Cl2 ra ngoài môi trường gây độc hại cho người làm thí nghiệm và ô nhiễm môi trường.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Quá trình điện phân NaCl nóng chảy được tiến hành theo hai bước như sau:
Bước 1: Nung NaCl trong bình đến nóng chảy, thu được chất lỏng có khả năng dẫn điện.
Bước 2: Nhúng hai điện cực than chì vào bình đựng NaCl nóng chảy rồi nối chúng với hai cực của nguồn điện một chiều (khoảng 7 V). Các ion di chuyển về các điện cực trái dấu, ở điện cực dương có khí Cl2 thoát ra và ở điện cực âm, Na được tạo thành.
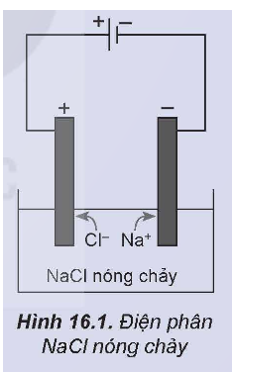
Thực hiện các yêu cầu sau:
1. Viết phương trình phân li của NaCl ở bước 1.
2. Viết quá trình xảy ra ở mỗi điện cực.
3. Viết phương trình hoá học của phản ứng xảy ra trong quá trình điện phân.
Quá trình điện phân NaCl nóng chảy được tiến hành theo hai bước như sau:
Bước 1: Nung NaCl trong bình đến nóng chảy, thu được chất lỏng có khả năng dẫn điện.
Bước 2: Nhúng hai điện cực than chì vào bình đựng NaCl nóng chảy rồi nối chúng với hai cực của nguồn điện một chiều (khoảng 7 V). Các ion di chuyển về các điện cực trái dấu, ở điện cực dương có khí Cl2 thoát ra và ở điện cực âm, Na được tạo thành.

Thực hiện các yêu cầu sau:
1. Viết phương trình phân li của NaCl ở bước 1.
2. Viết quá trình xảy ra ở mỗi điện cực.
3. Viết phương trình hoá học của phản ứng xảy ra trong quá trình điện phân.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.