Giải SBT Hóa học 12 KNTT Bài 15: Thế điện cực và nguồn điện hoá học có đáp án
43 người thi tuần này 4.6 1.2 K lượt thi 38 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: B
Quá trình khử là quá trình nhận electron: Mn+ + ne → M.
Lời giải
Đáp án đúng là: A
Cặp oxi hóa khử với dạng oxi hóa /dạng khử là: Fe3+/Fe2+.
Lời giải
Đáp án đúng là: B
Cặp oxi hoá - khử có thế điện cực chuẩn bằng 0 là 2H+/H2.
Lời giải
Đáp án đúng là: D
Theo quy ước: Cặp oxi hóa khử của kim loại có tính khử yếu đứng sau hydrogen trong dãy điện hóa sẽ có thế điện cực chuẩn lớn hơn 0: Cu2+/Cu.
Lời giải
Đáp án đúng là: C
Theo thứ tự trong dãy điện hóa ion đứng sau sẽ có tính oxi hóa mạnh hơn ion đứng trước nên ion có tính oxi hóa mạnh nhất là Ag+.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 8
Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
|
Cặp oxi hoá-khử |
Li+/Li |
Mg2+/Mg |
Zn2+/Zn |
Ag+/Ag |
|
Thế điện cực chuẩn, V |
-3,040 |
-2,356 |
-0,762 |
+0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg.
B. Zn.
C. Ag.
D. Li.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 26
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
A. khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
B. khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
C. khối lượng cả hai điện cực Zn và Cu đều tăng.
D. khối lượng cả hai điện cực Zn và Cu đều giảm.
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
A. khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
B. khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
C. khối lượng cả hai điện cực Zn và Cu đều tăng.
D. khối lượng cả hai điện cực Zn và Cu đều giảm.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 29
Một pin điện hoá Zn - H2 được thiết lập ở các điều kiện như hình vẽ sau (vôn kế có điện trở rất lớn).
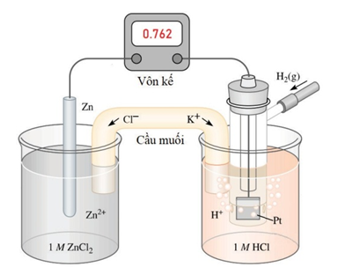
a) Giá trị thế điện cực chuẩn của cặp oxi hoá/ khử Zn2+/Zn là 0,762V.
b) Quá trình khử xảy ra ở cathode là: 2H+ + 2e ⟶ H2.
c) Chất điện li trong cầu muối là KCl.
d) Phản ứng hoá học xảy ra trong pin là: Zn + 2H+⟶ Zn2+ + H2.
Một pin điện hoá Zn - H2 được thiết lập ở các điều kiện như hình vẽ sau (vôn kế có điện trở rất lớn).

a) Giá trị thế điện cực chuẩn của cặp oxi hoá/ khử Zn2+/Zn là 0,762V.
b) Quá trình khử xảy ra ở cathode là: 2H+ + 2e ⟶ H2.
c) Chất điện li trong cầu muối là KCl.
d) Phản ứng hoá học xảy ra trong pin là: Zn + 2H+⟶ Zn2+ + H2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.