Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Để điều chế một lượng nhỏ khí chlorine trong phòng thí nghiệm, người ta cho dung dịch HCl đặc phản ứng với MnO2 rắn theo sơ đồ thí nghiệm như hình dưới đây, trong đó bình (1) chứa NaCl(aq) giúp giữ khí HCl, bình (2) chứa H2SO4 (l) đặc giúp hút ẩm, làm khô khí, bảo đảm chất lượng chlorine.
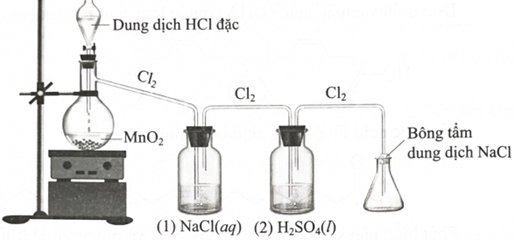
a. Dung dịch HCl đặc đóng vai trò là chất oxi hoá trong phản ứng điều chế chlorine.
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Để điều chế một lượng nhỏ khí chlorine trong phòng thí nghiệm, người ta cho dung dịch HCl đặc phản ứng với MnO2 rắn theo sơ đồ thí nghiệm như hình dưới đây, trong đó bình (1) chứa NaCl(aq) giúp giữ khí HCl, bình (2) chứa H2SO4 (l) đặc giúp hút ẩm, làm khô khí, bảo đảm chất lượng chlorine.

a. Dung dịch HCl đặc đóng vai trò là chất oxi hoá trong phản ứng điều chế chlorine.
Câu hỏi trong đề: (2025 mới) Đề ôn thi tốt nghiệp THPT Hóa (Đề số 1) !!
Quảng cáo
Trả lời:
Sai
Câu hỏi cùng đoạn
Câu 2:
b. Bông tẩm dung dịch NaOH giúp ngăn khí chlorine rò rỉ ra ngoài.
b. Bông tẩm dung dịch NaOH giúp ngăn khí chlorine rò rỉ ra ngoài.
Đúng
Câu 3:
c. Khi thay MnO2 bằng KMnO4 cùng khối lượng, lượng Cl2 thu được sẽ nhiều hơn, biết HCl đặc dùng dư. Cho phương trình hoá học của phản ứng giữa KMnO4 và HCl là:
\(2{\rm{KMn}}{{\rm{O}}_4} + 16{\rm{HCl}} \to 2{\rm{KCl}} + 2{\rm{MnC}}{{\rm{l}}_2} + 8{{\rm{H}}_2}{\rm{O}} + 5{\rm{C}}{{\rm{l}}_2}\)
c. Khi thay MnO2 bằng KMnO4 cùng khối lượng, lượng Cl2 thu được sẽ nhiều hơn, biết HCl đặc dùng dư. Cho phương trình hoá học của phản ứng giữa KMnO4 và HCl là:
\(2{\rm{KMn}}{{\rm{O}}_4} + 16{\rm{HCl}} \to 2{\rm{KCl}} + 2{\rm{MnC}}{{\rm{l}}_2} + 8{{\rm{H}}_2}{\rm{O}} + 5{\rm{C}}{{\rm{l}}_2}\)
Đúng
Câu 4:
d. Nếu hoán đổi vị trí bình (1) và bình (2), chất lượng khí chlorine thu được sẽ không đổi.
d. Nếu hoán đổi vị trí bình (1) và bình (2), chất lượng khí chlorine thu được sẽ không đổi.
Sai
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Số mol kết tủa sinh ra là x mol; tích số tan của Sr(OH)2 trong dung dịch sản phẩm (V = 200 mL):
\({{\rm{K}}_{{\rm{sp}}}} = \frac{{0,15 - {\rm{x}}}}{{0,2}}{\left( {\frac{{0,1 - 2{\rm{x}}}}{{0,2}}} \right)^2} = 3,2 \cdot {10^{ - 4}}\)
Do \(0,15 - x > 0\) và \(0,1 - 2x > 0\) nên \(x = 0,0475\) mol.
\({{\rm{m}}_{{\rm{Sr}}{{({\rm{OH}})}_2}}} = 0,0475 \cdot 122 = 5,795\;{\rm{g}}.\)
Đáp án: 5,8g
Lời giải
Từ kết quả so sánh số mol FeCl3 và số mol K2C2O4, chọn tính toán lí thuyết theo số mol FeCl3.
Số mol phức chất thu được theo lí thuyết bằng số mol FeCl3 và là:
1,61 : 162,5 = 9,9. 10-3 (mol).
Khối lượng phức chất thu được theo lí thuyết là:
491. 9,9. 10-3 = 4,86 (g).
Hiệu suất phản ứng là:
(3,51: 4,86). 100% = 72,2%.
Đáp án: 72,2%
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
B. phản ứng oxi hoá - khử xảy ra trong dung dịch.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
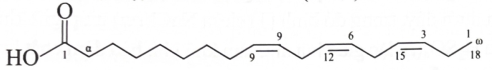
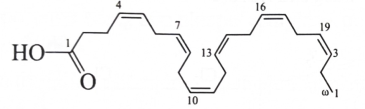
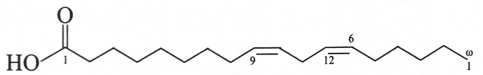
A. Các acid omega-3 và omega-6 có tác dụng giảm huyết áp, giảm cholesterol trong cơ thể.
B. Các acid omega-3 và omega-6 là các carboxylic acid mạch dài, không nhánh.
C. Phân tử các acid omega-3 và omega-6 có liên kết đôi lần lượt tại vị trí số 3 và số 6 tương ứng, tính từ nhóm CH3 ở đuôi phân tử.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. Sự tích tụ bùn từ xác tảo ngăn cản oxygen khuếch tán vào nước.
B. Sự phát triển dày đặc của tảo xanh trong nước tới mức có thể quan sát được.
C. Lượng oxygen trong nước sẽ nhanh chóng giảm đi.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.