Dựa vào phản ứng (*) trong Bảng 5.1, cho biết phèn nhôm – kali sẽ khó tạo chất không tan dạng keo trong môi trường nào sau đây: nước trung tính, nước có pH < 7, nước có pH > 7. Giải thích.
Dựa vào phản ứng (*) trong Bảng 5.1, cho biết phèn nhôm – kali sẽ khó tạo chất không tan dạng keo trong môi trường nào sau đây: nước trung tính, nước có pH < 7, nước có pH > 7. Giải thích.
Quảng cáo
Trả lời:
Dựa vào phản ứng (*) ta thấy khi tăng nồng độ H+, cân bằng sẽ chuyển dịch theo chiều nghịch, làm hoà tan kết tủa keo.
Do đó, phèn nhôm – kali sẽ khó tạo chất không tan dạng keo trong môi trường nước có pH < 7 (hay môi trường có tính acid).
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Phương trình phản ứng thuỷ phân phèn sắt – ammonium:
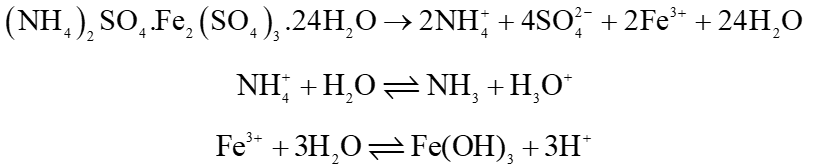
b) Dùng phèn nhôm sẽ ít ảnh hưởng đến màu sắc của nước hơn do trong dung dịch ion Al3+ không có màu, còn ion Fe3+ có màu.
Lời giải
- Khi cho phèn chua (hay phèn nhôm – kali) vào nước, xảy ra quá trình phân li hoàn toàn như sau:
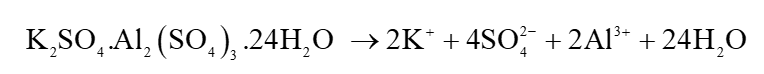
Sau đó Al3+ bị thuỷ phân:
Do quá trình thuỷ phân Al3+ sinh ra ion H+ nên làm pH của nước giảm so với ban đầu.
- Để làm tăng pH của nước người ta có thể cho nước vôi trong hoặc dung dịch soda vào nước vì:
+ Khi cho nước vôi trong vào nước: Ca(OH)2 → Ca2+ + OH−
OH− phân li ra trung hoà H+ có trong nước làm tăng pH của nước.
+ Khi cho dung dịch soda vào nước:
Sau đó ion CO32- bị thuỷ phân:
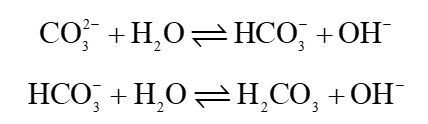
OH− sinh ra trung hoà H+ có trong nước làm tăng pH của nước.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
