Vẽ một bình điện phân trong đó Mn2+ bị khử thành Mn và Sn bị oxi hoá thành Sn2+ . Ghi nhãn cho cực dương và cực âm, chỉ ra hướng chuyển động của các electron và viết phương trình hoá học xảy ra ở mỗi điện cực. Điện áp tối thiểu cần thiết để xảy ra sự điện phân là bao nhiêu? Biết \[E_{M{n^{2 + }}/Mn}^0 = - 1,{18_{}}V\].
Vẽ một bình điện phân trong đó Mn2+ bị khử thành Mn và Sn bị oxi hoá thành Sn2+ . Ghi nhãn cho cực dương và cực âm, chỉ ra hướng chuyển động của các electron và viết phương trình hoá học xảy ra ở mỗi điện cực. Điện áp tối thiểu cần thiết để xảy ra sự điện phân là bao nhiêu? Biết \[E_{M{n^{2 + }}/Mn}^0 = - 1,{18_{}}V\].
Câu hỏi trong đề: Giải SBT Hóa 12 Cánh diều Bài 12: Điện phân có đáp án !!
Quảng cáo
Trả lời:
|
Vì Mn2+ bị khử thành Mn nên Mn là cathode (cực âm của bình điện phân): \[M{n^{2 + }} + 2e \to M{n_{}}_{}_{}^{}E_{M{n^{2 + }}/Mn}^0 = - 1,{18^{}}V.\] Sn bị oxi hóa thành Sn2+ nên Sn là anode (cực dương của bình điện phân: \[Sn \to S{n^{2 + }} + 2{e_{}}{^{}_{}}E_{S{n^{2 + }}/Sn}^0 = - 0,138V\] Phản ứng xảy ra trong bình điện phân ngược với phản ứng tự xảy ra trong pin điện nên E = Ecathode – Eanode = -1,18 V – (-0,138 V) = -1,042 V. Vậy điện áp tối thiểu để quá trình điện phân xảy ra là 1,042 V. |
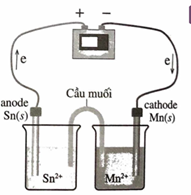 |
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- Sổ tay Hóa học 12 (chương trình mới) ( 18.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a. Khối lượng Al có trong 1000kg quặng là 400kg tương ứng với khối lượng Al2O3 là\[\frac{{400}}{{27.2}}.102 = 755,56kg\]
Vậy phần trăm tạp chất trong loại quặng trên là
\[\frac{{1000 - 755,56}}{{1000}}.100\% = 24,4\% \]
b. Số mol Al trong 1000kg quặng trên là
\[\frac{{{{10}^3}{{.10}^3}}}{{27}}.40\% = 14815\,mol\]
Số mol electron cần cho quá trình điện phân là
3.14815 = 44 445 mol vì Al3+ + 3e → Al.
Áp dụng công thức tính được t = 428894,25 s = 119,14 giờ.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
