Phần 2. Trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d ở mỗi câu, học sinh chọn đúng hoặc sai.
Ợ nóng” là cảm giác đau rát ở thực quản gây ra do sự gia tăng nồng độ hydrochloric acid (HCl) trong dạ dày. Cách đơn giản để giảm chứng ợ nóng nhẹ là nuốt nước bọt nhiều lần, do nước bọt có chứa ion bicarbonate. Ngoài ra, có thể điều trị chứng ợ nóng bằng các thuốc kháng acid, chẳng hạn “sữa magie” có thành phần chủ yếu là huyền phù magnesium hydroxide.
a. Ion bicarbonate trong nước bọt hoạt động như một base, khi nuốt vào sẽ trung hòa một phần acid có trong thực quản.
b. Phản ứng hóa học giữa HCl và 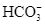 là:
là: 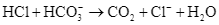
c. Sữa magie là thuốc acid có thể điều trị chứng ợ nóng.
d. Sữa magie có thành phần chính là muối của 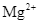 .
.
Phần 2. Trắc nghiệm đúng sai. Trong mỗi ý a, b, c, d ở mỗi câu, học sinh chọn đúng hoặc sai.
Ợ nóng” là cảm giác đau rát ở thực quản gây ra do sự gia tăng nồng độ hydrochloric acid (HCl) trong dạ dày. Cách đơn giản để giảm chứng ợ nóng nhẹ là nuốt nước bọt nhiều lần, do nước bọt có chứa ion bicarbonate. Ngoài ra, có thể điều trị chứng ợ nóng bằng các thuốc kháng acid, chẳng hạn “sữa magie” có thành phần chủ yếu là huyền phù magnesium hydroxide.
a. Ion bicarbonate trong nước bọt hoạt động như một base, khi nuốt vào sẽ trung hòa một phần acid có trong thực quản.
b. Phản ứng hóa học giữa HCl và ![]() là:
là: ![]()
c. Sữa magie là thuốc acid có thể điều trị chứng ợ nóng.
d. Sữa magie có thành phần chính là muối của ![]() .
.
Câu hỏi trong đề: 28 bài tập Cân bằng hoá học có đáp án !!
Quảng cáo
Trả lời:
|
a |
Đ |
|
b |
Đ |
|
c |
S |
|
d |
S |
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Chọn C
![]()
![]()
H2 (g) + I2 (g) ![]() 2HI (g)
2HI (g)
Bđ: 0,2 0,16 M
Pư: x x 2x M
Cb: 0,2-x 0,16-x 2x M
⇒ 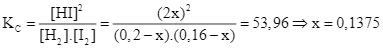
⇒ [HI]= 2x = 0,275M
Lời giải
Chọn B
Các phát biểu đúng bao gồm : 1, 3, 4.
(2) Sai vì cân bằng hóa học là cân bằng động.
(5) Sai vì khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng tiếp tục xảy ra với tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
(6) Sai vì cân bằng hóa học là trạng thái mà tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Câu 3
Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, một học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu A và B.
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1M vào cốc A; 50 mL dung dịch HCl 2M vào cốc B.
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
a. Nếu trong cùng một khoảng thời gian, lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
b. Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc A, 1 gam bột Zn vào cốc B thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
c. “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
d. Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm không còn phù hợp để trả lời câu hỏi trên.
Khi tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng, để trả lời cho câu hỏi “Nồng độ chất tham gia ảnh hưởng đến tốc độ phản ứng như thế nào?”, một học sinh đã tiến hành thí nghiệm theo các bước:
Bước 1: Chuẩn bị 2 cốc thuỷ tinh 250 mL được đánh dấu A và B.
Bước 2: Rót 50 mL dung dịch hydrochloric acid (HCl) 1M vào cốc A; 50 mL dung dịch HCl 2M vào cốc B.
Bước 3: Cho 1 gam bột kẽm (Zn) vào mỗi cốc. Quan sát hiện tượng xảy ra ở 2 cốc.
a. Nếu trong cùng một khoảng thời gian, lượng khí thoát ra ở cốc nào nhiều hơn thì có thể kết luận tốc độ phản ứng ở cốc đó lớn hơn cốc còn lại.
b. Ở bước 3, nếu cho 1 gam Zn dạng viên vào cốc A, 1 gam bột Zn vào cốc B thì có thể cho thấy được tốc độ phản ứng phụ thuộc vào nồng độ.
c. “Tốc độ phản ứng không phụ thuộc vào nồng độ chất tham gia” có thể là một giả thuyết tương ứng với câu hỏi trên.
d. Ở bước 3, nếu sử dụng bột đồng (Cu) thay cho bột Zn thì thí nghiệm không còn phù hợp để trả lời câu hỏi trên.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.