PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Trong tự nhiên quặng bauxite có thành phần chính là Al2O3. Quặng bauxite mỏ Tây Tân Rai – Lâm Đồng nói riêng và các mỏ thuộc vùng Tây nguyên của Việt Nam nói chung là loại quặng bauxite có nguồn gốc phong hóa từ các loại đá bazan, quặng thường có màu nâu sẫm, nâu đỏ, hoặc xám, xám phớt vàng.
a. Quặng bauxite là nguyên liệu dùng để sản xuất aluminium (nhôm) trong công nghiệp.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Trong tự nhiên quặng bauxite có thành phần chính là Al2O3. Quặng bauxite mỏ Tây Tân Rai – Lâm Đồng nói riêng và các mỏ thuộc vùng Tây nguyên của Việt Nam nói chung là loại quặng bauxite có nguồn gốc phong hóa từ các loại đá bazan, quặng thường có màu nâu sẫm, nâu đỏ, hoặc xám, xám phớt vàng.
a. Quặng bauxite là nguyên liệu dùng để sản xuất aluminium (nhôm) trong công nghiệp.
Quảng cáo
Trả lời:
Đúng vì quặng bauxite là Al2O3.nH2O.
Câu hỏi cùng đoạn
Câu 2:
b. Để thu được kim loại Al từ quặng bauxite người ta dùng phương pháp điện phân nóng chảy Al2O3.
b. Để thu được kim loại Al từ quặng bauxite người ta dùng phương pháp điện phân nóng chảy Al2O3.
Đúng vì thế điện cực chuẩn của Al3+/Al nhỏ hơn H2O/H2, OH- nên chỉ điều chế bằng điện phân nóng chảy.
Câu 3:
c. Bể điện phân Al2O3 nóng chảy có các điện cực làm bằng thép.
c. Bể điện phân Al2O3 nóng chảy có các điện cực làm bằng thép.
Sai vì phương trình điện phân nóng chảy như sau: 2 Al2O34Al + 3 O2
Nếu điện cực bằng thép thì sẽ bị oxi hóa bởi O2 sinh ra.
Câu 4:
d. Có phương trình nhiệt hóa học: 2Al2O3(s) 4Al(s) + 3O2 (g) ΔrHo298= 1676,00 kJ. Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% và 1 kWh = 3,6.106 J, thì cần tiêu tốn 5747,6 kWh.
d. Có phương trình nhiệt hóa học: 2Al2O3(s) 4Al(s) + 3O2 (g) ΔrHo298= 1676,00 kJ. Để thu được 1 tấn Al với hiệu suất sử dụng năng lượng đạt 75% và 1 kWh = 3,6.106 J, thì cần tiêu tốn 5747,6 kWh.
Sai vì ta có: \[{n_{Al}} = \frac{{{{1.10}^6}}}{{27}}\,mol\]
Theo phương trình: 4 mol Al sinh ra thì cần 1676 kJ\[ \Rightarrow E = \frac{{{{1.10}^6}}}{{27}}.\frac{{1676}}{4}\,\,kJ\]
Mà quá trình sử dụng năng lượng là 75% nên thực tế cần: \[\frac{{{{1.10}^6}}}{{27}}.\frac{{1676}}{4}.75\% = \frac{{104750000}}{9}\,kJ\]
Số kWh cần là\[\frac{{\frac{{104750000}}{9}{{.10}^3}}}{{3,{{6.10}^6}}} = 3233,024\,\,kWh\]
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
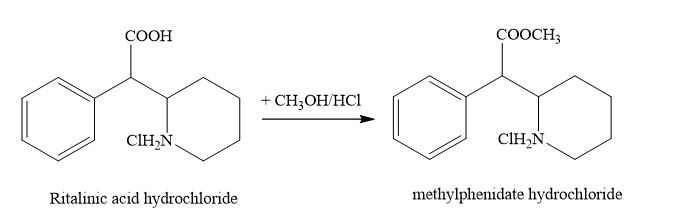
Ta có: \({m_{methylphenidate\,hydrochloride}} = {10.30.5.10^6} = 1,{5.10^9}\,mg = 1,5\,\)tấn
Khối lượng ritalinic acid hydrochloride là \(1,5.\frac{{\overbrace {213,5}^{{M_{ritalinic\,\,acid\,hydrochloride}}}}}{{\underbrace {227,5}_{{M_{methylphenidate\,hydrochloride}}}}}.\frac{{100}}{{75}} = 2,75 \approx 2,8\)tấn
Câu 2
Lời giải
Chọn A
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.