Người ta mạ nickel lên mặt vật kim loại bằng phương pháp mạ điện, dung dịch điện phân chứa \[NiS{O_4},\]cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%). (Làm tròn kết quả đến hàng phần mười)
Người ta mạ nickel lên mặt vật kim loại bằng phương pháp mạ điện, dung dịch điện phân chứa \[NiS{O_4},\]cực dương là Ni kim loại, cực âm là vật kim loại cần mạ. Nếu dòng điện có cường độ 1,5 A chạy qua dung dịch trong 2 giờ thì khối lượng nickel được mạ lên vật là bao nhiêu? (Cho biết khối lượng mol của Ni = 58,7 g/mol, hằng số Faraday F = 96500 C/mol, hiệu suất quá trình điện phân là 100%). (Làm tròn kết quả đến hàng phần mười)
Câu hỏi trong đề: Đề kiểm tra Hóa 12 Kết nối tri thức Chương 5 có đáp án !!
Quảng cáo
Trả lời:
Hướng dẫn giải
Đáp án đúng là: 3,3.
Ta có: \(I.t{\rm{ }} = {\rm{ }}{n_e}.F \Rightarrow {n_e} = \frac{{I.t}}{F} = \frac{{1,5.7200}}{{96500}} = 0,1119\,\,mol\)
Phương trình điện phân:
\[\begin{array}{l}N{i^{2 + }}\,\,\,\,\,\,\,\,\,\,\,\, + {\rm{ }}\,\,\,\,\,\,\,\,{\rm{ }}2e{\rm{ }}\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,{\rm{ }}Ni\\\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1119\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\frac{{0,1119}}{2}{\rm{ }}mol\end{array}\]
m Ni mạ = \[\frac{{0,1119}}{2}.58,7 \approx 3,3{\rm{ }}g.\]
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Hướng dẫn giải
Đáp án đúng là: 1,64
Đổi: 20 cm = 0,2 m; 0,01 mm = 0,001 cm.
\(\begin{array}{l}S = 3,14 \times {(0,2)^2} = 0,1256\;{{\rm{m}}^2} = 1256\;{\rm{c}}{{\rm{m}}^2} \Rightarrow {V_{Ag}} = 1256.0,001 = 1,256(\;{\rm{c}}{{\rm{m}}^3}).\\ \Rightarrow {m_{Ag}} = 1,256.10,5 = 13,188\;({\rm{g)}} \Rightarrow {n_{Ag}} = \frac{{13,188}}{{108}} = 0,1222\;{\rm{mol}}{\rm{.}}\end{array}\)
Ta có: \(Q = {n_e}.F = I.t \Rightarrow t = \frac{{{n_e}.F}}{I} = \frac{{0,1222.96500}}{2} = 5896,5\,\,(s) \simeq 1,64\,(h).\)
Lời giải
Hướng dẫn giải
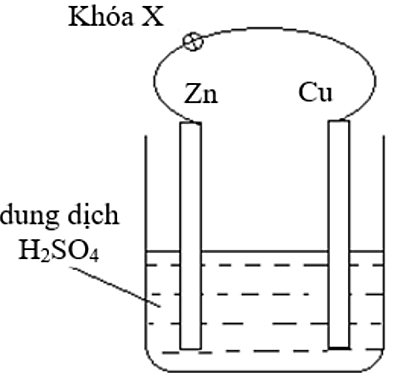
a. Sai. Khi thay thanh Cu bằng thanh Mg, thanh Mg bị ăn mòn điện hóa, do tính khử của Mg mạnh hơn Zn.
b. Đúng. Khi chưa đóng khóa X xảy ra ăn mòn hóa học.
Zn + H2SO4 → ZnSO4 + H2
c. Sai. Tốc độ bọt khí thoát ra khi mở khóa X và khi đóng khóa X là khác nhau. Khi đóng khóa X tốc độ bọt khí diễn ra nhanh hơn.
d. Đúng. Khi đóng khóa X, xảy ra ăn mòn điện hóa và thanh Zn bị ăn mòn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.