Một bình chứa được \(7{\rm{ g}}\) khí Nitơ (\({N_2}\)) ở nhiệt độ 27oC dưới áp suất \(5,11 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\). Người ta thay khí Nitơ bằng khí \(X\) khác. Lúc này nhiệt độ là 53oC, bình chỉ chứa được \(4{\rm{ g}}\) khí đó dưới áp suất \(44,4 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\). Hỏi khí \(X\) là khí gì?
Một bình chứa được \(7{\rm{ g}}\) khí Nitơ (\({N_2}\)) ở nhiệt độ 27oC dưới áp suất \(5,11 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\). Người ta thay khí Nitơ bằng khí \(X\) khác. Lúc này nhiệt độ là 53oC, bình chỉ chứa được \(4{\rm{ g}}\) khí đó dưới áp suất \(44,4 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\). Hỏi khí \(X\) là khí gì?
Câu hỏi trong đề: 10000 câu trắc nghiệm tổng hợp Vật lí 2025 có đáp án !!
Quảng cáo
Trả lời:
Lời giải:
Phương trình trạng thái của khí lý tưởng (Phương trình Mendeleev - Clapeyron):
\(P \cdot V = \frac{m}{M} \cdot R \cdot T\)
Trong đó:
- \(P\): Áp suất (\({\rm{N/}}{{\rm{m}}^2}\) hoặc \({\rm{Pa}}\))
- \(V\): Thể tích bình (\({{\rm{m}}^3}\))
- \(m\): Khối lượng khí (\({\rm{g}}\))
- \(M\): Khối lượng mol (\({\rm{g/mol}}\))
- \(R \approx 8,31{\rm{ J/(mol}}{\rm{.K)}}\): Hằng số khí lý tưởng
- \(T\): Nhiệt độ tuyệt đối (\({\rm{K}}\)), với \(T = {t^^\circ }{\rm{C}} + 273\)
Bước 1: Xét trạng thái khí Nitơ (\({N_2}\))
- \({m_1} = 7{\rm{ g}}\), \({M_1} = 28{\rm{ g/mol}}\)
- \({T_1} = 27 + 273 = 300{\rm{ K}}\)
- \({P_1} = 5,11 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\)
Ta có: \({P_1} \cdot V = \frac{{{m_1}}}{{{M_1}}} \cdot R \cdot {T_1} \Rightarrow V = \frac{{{m_1} \cdot R \cdot {T_1}}}{{{M_1} \cdot {P_1}}}\) (1)
Bước 2: Xét trạng thái khí X
- \({m_2} = 4{\rm{ g}}\), \({M_X} = ?\)
- \({T_2} = 53 + 273 = 326{\rm{ K}}\)
- \({P_2} = 44,4 \cdot {10^5}{\rm{ N/}}{{\rm{m}}^2}\)
Ta có: \({P_2} \cdot V = \frac{{{m_2}}}{{{M_X}}} \cdot R \cdot {T_2} \Rightarrow V = \frac{{{m_2} \cdot R \cdot {T_2}}}{{{M_X} \cdot {P_2}}}\) (2)
Bước 3: Lập tỉ lệ để tìm \({M_X}\)
Vì thể tích bình \(V\) không đổi, từ (1) và (2) ta có:
\(\frac{{{m_1} \cdot {T_1}}}{{{M_1} \cdot {P_1}}} = \frac{{{m_2} \cdot {T_2}}}{{{M_X} \cdot {P_2}}}\)
Rút ra công thức tìm \({M_X}\):
\({M_X} = \frac{{{m_2} \cdot {T_2} \cdot {M_1} \cdot {P_1}}}{{{m_1} \cdot {T_1} \cdot {P_2}}}\)
Thay số:
\({M_X} = \frac{{4 \cdot 326 \cdot 28 \cdot 5,11 \cdot {{10}^5}}}{{7 \cdot 300 \cdot 44,4 \cdot {{10}^5}}} \approx 2,016{\rm{ (g/mol)}}\)
Kết luận:
Vì \({M_X} \approx 2{\rm{ g/mol}}\), nên khí \(X\) chính là khí Hiđrô (\({H_2}\)).
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Lời giải:
\[c\'o \;M = \frac{m}{n} = \frac{{m.22,4}}{V} = \frac{{m.22,4}}{{m/D}} = D*22,4\]
\( = > D = \frac{M}{{22,4}}\)
\({M_1} = {29.10^{ - 3}}\)
\({T_1} = 273K\)
\({M_2} = ?\)
\({T_2} = 300K\)
\(c\'o :\;\frac{{{D_1}}}{{{D_2}}} = \frac{{{T_2}}}{{{T_1}\;}} = > \;\frac{{{M_1}}}{{{M_2}}} = \frac{{{T_2}}}{{{T_1}}}\; = > \;{M_2}\~0,026\)
\[{D_2} = \frac{{{M_2}}}{{22,4}}\; = > \;{D_2} = \;1,178\left( {kg/{m^3}} \right)\]
Lời giải
Lời giải:
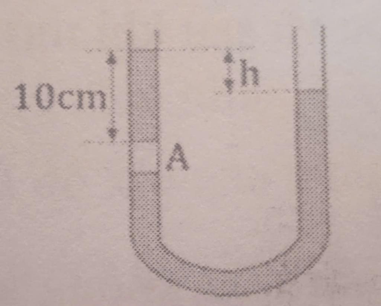
Để cột khí đứng yên thì áp suất do thủy ngân bên trên cân bằng với áp suất do bên dưới gây ra:
\({p_C} = {p_B} = {h_C} + {p_0}\)
Áp suất chất lỏng đứng yên tại cùng mức ngang thì bằng nhau:
\({p_B} = {p_D} = {h_D} + {p_0}\)
Do đó ta suy ra: \({p_B} = {p_C} = {p_B} = {h_C} + {p_0} = {h_D} + {p_0}\)
\( \Rightarrow {h_C} = {h_D} = 10{\rm{ (cm)}}\)
Độ cao chênh lệch của mặt thủy ngân là:
\(\Delta h = {h_B} - {h_D} = (10 + 2) - 10 = 2{\rm{ (cm)}}.\)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.