Cho các cân bằng sau:
(1) H2(k) + I2(k) D 2HI(k)
(2) ![]() H2(k) +
H2(k) + ![]() I2(k) D
I2(k) D![]() HI(k)
HI(k)
(3) 2HI(k) D H2(k) + I2 (k)
(4) HI(k) D ![]() H2(k) +
H2(k) + ![]() I2 (k)
I2 (k)
(5) H2(k) + I2(r) D HI (k)
Ở nhiệt độ xác định, nếu Kc của cân bằng (1) bằng 64 thì Kc bằng 0,125 là của cân bằng
A.(4).
B.(2).
C. (3).
D. (5).
Câu hỏi trong đề: Bài tập Tốc độ phản ứng hóa học siêu hay có lời giải !!
Quảng cáo
Trả lời:
Đáp án C
Vậy H = 80%
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. tăng 9 lần.
B. giảm 3 lần.
C. tăng 4,5 lần.
D. tăng 3 lần.
Lời giải
Đáp án D
Hằng số cân bằng: 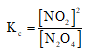
Khi tăng nồng độ N2O4 lên 9 lần đê’hằng số K không đổi thì nồng độ NO2 phải tăng lên 3 lần
Lời giải
Đáp án A
Phản ứng: H2O (k) + CO (k) D H2 (k) + CO2 (k)
Ban đầu: 0,03 0,03 0 0 (M)
Phản ứng x x x x (M)
Cân bằng: (0,03-x)(0,03-x) x x (M)
Hằng số cân bằng:
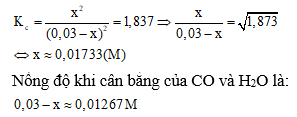
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A.4807
B.120
C.8,33.10-3
D.2,08.10-4
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. 0,1225M
B. 0,35M
C. 1,00M
D. Đáp án khác
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.