Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Các nguyên tố chu kì 2 có bao nhiêu lớp electron? Vẽ mô hình nguyên tử theo Rutherford – Bohr của Li và F để giải thích về sự khác biệt bán kính nguyên tử.
Quảng cáo
Trả lời:
- Các nguyên tố chu kì 2 có 2 lớp electron.
- Mô hình nguyên tử của Li (Z = 3) và F (Z = 9) theo Rutherford – Bohr như sau:
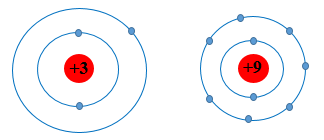
Li và F đều cùng có 2 lớp electron, tuy nhiên điện tích hạt nhân của F lớn hơn Li nên hạt nhân của F sẽ hút electron lớp ngoài cùng mạnh hơn làm cho bán kính nguyên tử F nhỏ hơn Li.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
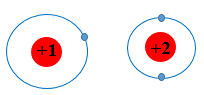
Đều có 1 lớp electron nhưng nguyên tử He có điện tích hạt nhân +2 lớn hơn nguyên tử H (điện tích hạt nhân là +1) nên hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính của He nhỏ hơn bán kính của H.
Mặt khác, nguyên tử He chỉ có 1 lớp electron nên bán kính là nhỏ nhất trong bảng tuần hoàn.
Lời giải
(1) tăng
(2) giảm
(3) kim loại kiềm (kim loại điển hình)
(4) Francium (Fr)
(5) 6
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.