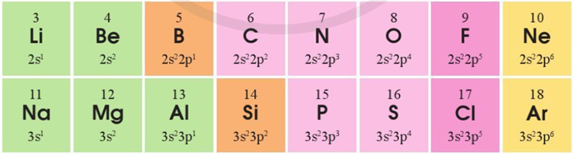
Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiều ...(1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide của các nguyên tố có xu hướng ...(2)... dần.
c) Nhóm ...(3)... là nhóm chứa các nguyên tố đứng đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(4)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(5)...
Hoàn thành chỗ trống trong các câu sau:
a) Trong một chu kì, theo chiều ...(1)... điện tích hạt nhân, độ âm điện của các nguyên tố có xu hướng tăng dần, tính base của các hydroxide của các nguyên tố có xu hướng ...(2)... dần.
c) Nhóm ...(3)... là nhóm chứa các nguyên tố đứng đầu mỗi chu kì trong bảng tuần hoàn. Trong nhóm này, nguyên tử nguyên tố ...(4)... có bán kính lớn nhất. Số lượng các nguyên tố là kim loại của nhóm này là ...(5)...
Quảng cáo
Trả lời:
(1) tăng
(2) giảm
(3) kim loại kiềm (kim loại điển hình)
(4) Francium (Fr)
(5) 6
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
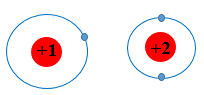
Đều có 1 lớp electron nhưng nguyên tử He có điện tích hạt nhân +2 lớn hơn nguyên tử H (điện tích hạt nhân là +1) nên hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính của He nhỏ hơn bán kính của H.
Mặt khác, nguyên tử He chỉ có 1 lớp electron nên bán kính là nhỏ nhất trong bảng tuần hoàn.
Lời giải
- Các nguyên tố chu kì 2 có 2 lớp electron.
- Mô hình nguyên tử của Li (Z = 3) và F (Z = 9) theo Rutherford – Bohr như sau:
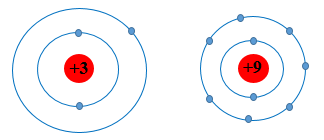
Li và F đều cùng có 2 lớp electron, tuy nhiên điện tích hạt nhân của F lớn hơn Li nên hạt nhân của F sẽ hút electron lớp ngoài cùng mạnh hơn làm cho bán kính nguyên tử F nhỏ hơn Li.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.