Câu hỏi trong đề: Chuyên đề Hóa 10 Bài 1: Liên kết hóa học có đáp án !!
Quảng cáo
Trả lời:
Phân tử chứa nguyên tử lai hóa sp3 không thể có cấu trúc phẳng. Vì khi 1 AO ns tổ hợp với 3 AO np tạo ra 4 AO lai hóa sp3. 4 AO sp3 này chiếm 4 khu vực điện tích âm sao cho lực đẩy giữa chúng là nhỏ nhất nên phân tử có dạng tứ diện, góc tạo bởi hai trục của hai AO là 109,5o.
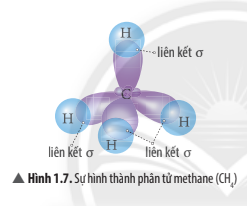
Ví dụ phân tử CH4
Từ công thức Lewis của CH4 ta xác định được phân tử này có dạng tứ diện theo mô hình VSEPR.
Cấu hình electron của C (Z = 6) là 1s22s22p2
1 AO 2s tổ hợp với 3 AO 2p tạo 4 AO lai hóa sp3
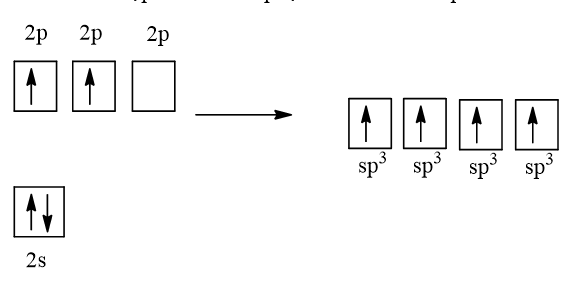
4 AO lai hóa sp3 của nguyên tử C xen phủ với 4 AO s của nguyên tử H tạo thành 4 liên kết σ hướng về 4 đỉnh của một tứ diện đều.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Lưu ý: Có thể dự đoán nhanh trạng thái lai hóa của nguyên tử A (nguyên tố s, p) trong một phân tử bất kì như sau:
- Xác định số nguyên tử liên kết trực tiếp với A.
- Xác định số cặp electron hóa trị riêng của A.
- Nếu tổng hai giá trị là 2; 3 hoặc 4 thì trạng thái lai hóa của A lần lượt là sp; sp2 hoặc sp3
a) Trong phân tử PCl3
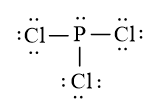
- Số nguyên tử liên kết với P là 3.
- Số cặp electron hóa trị riêng của P là 1
- Tổng hai giá trị là 4 ⇒ Trạng thái lai hóa của C là sp3.
b) Trong phân tử CS2
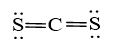
- Số nguyên tử liên kết với C là 2.
- Số cặp electron hóa trị riêng của C là 0
- Tổng hai giá trị là 2 ⇒ Trạng thái lai hóa của C là sp.
c) Trong phân tử SO2
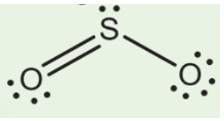
- Số nguyên tử liên kết với S là 2.
- Số cặp electron hóa trị riêng của S là 1
- Tổng hai giá trị là 3 ⇒ Trạng thái lai hóa của S là sp2.
Lời giải
- Từ công thức Lewis của H2O
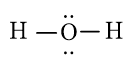
⇒ Công thức VSEPR của H2O là: AX2E2
- Từ công thức Lewis của NH3
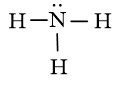
⇒ Công thức VSEPR của NH3 là: AX3E1
- Từ công thức Lewis của SO2
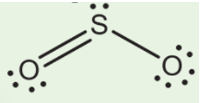
⇒ Công thức VSEPR của SO2 là AX2E1.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.