Chuyên đề Hóa 10 Bài 7: Hóa học về phản ứng cháy, nổ có đáp án
95 người thi tuần này 4.6 3.4 K lượt thi 16 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
- Tính biến thiên enthalpy của phản ứng cháy, nổ theo năng lượng liên kết.
- Tính biến thiên enthapy của phản ứng cháy, nổ theo nhiệt hình thành chuẩn của các chất
- Các yếu tố ảnh hưởng đến tốc độ phản ứng cháy:
+ Chất cháy.
+ Chất oxi hóa (oxygen)
+ Nguồn nhiệt
Lời giải
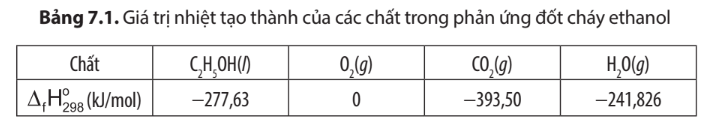
Phản ứng đốt cháy ethanol:
C2H5OH(l) + 3O2(g) 2CO2(g) + 3H2O(g)
= 2. (CO2, g) + 3. (H2O, g) - (C2H5OH, l) – 3. (O2, g)
= 2.(-393,50) + 3.(-241,826) – (-277,63) – 3.0 = -1234,85 kJ
Phản ứng đốt cháy 1 mol propane:
C3H8(g) + 5O2 (g) 3CO2(g) + 4H2O(g)
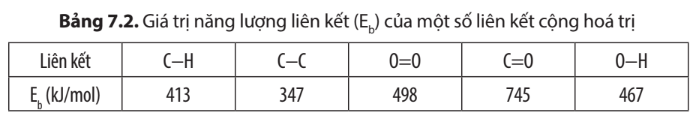
= Eb(C3H8) + 5.Eb(O2) – 3.Eb(CO2) – 4.Eb(H2O)
= (2.EC-C + 8.EC-H) + 5.EO=O – 3.2.EC=O – 4.2.EO-H
= (2.347 + 8.413) + 5.498 – 3.2.745 – 4.2.467 = -1718 kJ
Phản ứng đốt cháy 1 mol butane:
C4H10(g) + O2(g) 4CO2(g) + 5H2O(g)
= Eb(C4H10) + .Eb(O2) – 4.Eb(CO2) – 5.Eb(H2O)
= (3.EC-C + 10.EC-H) + .EO=O – 4.2.EC=O – 5.2.EO-H
= (3.347 + 10.413) + .498 – 4.2.745 – 5.2.467 = -2222 kJ
Biến thiên enthalpy phản ứng đốt cháy 1 mol khí gas chứa propane (40%) và butane (60%) là:
= (-1718).0,4 + (-2222).0,6 = -2020,4 kJ
Lời giải
Phản ứng đốt cháy 1 mol octane:
C8H18(g) + O2(g) 8CO2(g) + 9H2O(g)
∆r =Eb(C8H18) + .Eb(O2) – 8.Eb(CO2) – 9.Eb(H2O)
∆r = 7.EC-C + 18.EC-H + .EO=O – 8.2.EC=O – 9.2.EO-H
∆r = 7.347 + 18.413 + .498 – 8.2.745 – 9.2.467 = -4238 kJ
Đốt cháy 1 mol C8H18(g) tỏa ra 4238 kJ nhiệt lượng
Phản ứng đốt cháy 1 mol methane
CH4(g) + 2O2(g) CO2(g) + 2H2O(g)
∆r = Eb(CH4) + 2.Eb(O2) – Eb(CO2) – 2.Eb(H2O)
∆r = 4EC-H + 2.EO=O – 2.EC=O – 2.2.EO-H
∆r = 4.413 + 2.498 – 2.745 – 2.2.467 = -710 kJ
Đốt cháy 1 mol CH4(g) tỏa ra 710 kJ nhiệt lượng
Như vậy nhiệt lượng tỏa ra khi đốt cháy octane lớn hơn nhiều so với đốt cháy methane. Hay phản ứng đốt cháy octane xảy ra mãnh liệt hơn phản ứng đốt cháy methane.
Lời giải
Lấy 100 L không khí có 20,9 L oxygen
= = 0,179 mol
= 8,56.10-3 mol/L
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.