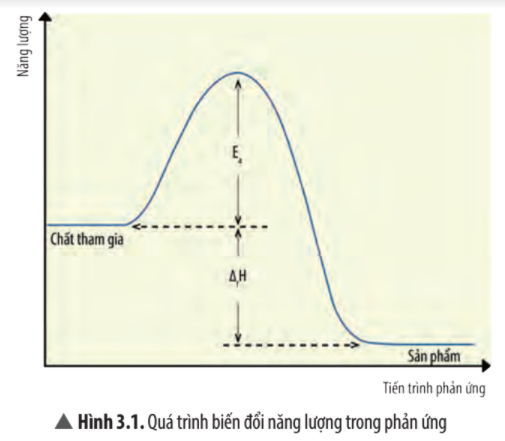
Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng ở 2 nhiệt độ là 27oC và 127oC.
Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng ở 2 nhiệt độ là 27oC và 127oC.
Quảng cáo
Trả lời:
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Hay
Thay số vào ta được:
⇔ = 11,08
Vậy khi tăng nhiệt độ từ 27oC lên 127oC thì tốc độ phản ứng tăng 11,08 lần.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Áp dụng phương trình Arrhenius viết lại cho hai nhiệt độ
T1 = 300K; T2 = 273K ứng với hai hằng số tốc độ k1 = 10-10s-1; k2 = ?
⇔
⇔ k2 = 1,23.10-12s-1
Vậy hằng số tốc độ phản ứng ở 273 K của phản ứng phân hủy là k2 = 1,23.10-12 s-1
Lời giải
a) Trong giản đồ (c) Ea’ là năng lượng hoạt hóa của phản ứng khi không có xúc tác.
Ea là năng lượng hoạt hóa của phản ứng khi có xúc tác.
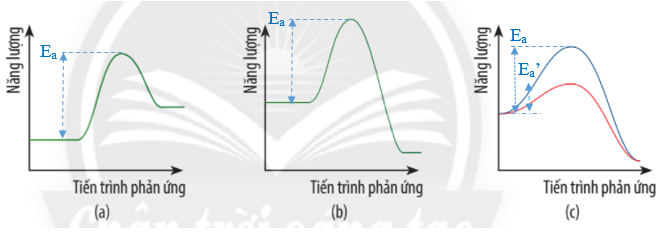
b) Giản đồ (c) biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng.
Đường màu xanh là năng lượng hoạt hóa khi không có xúc tác.
Đường màu đỏ là năng lượng hoạt hóa khi có xúc tác.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.