Lấy hai ví dụ minh họa điều chế khí Y từ chất rắn X theo mô hình thí nghiệm sau:
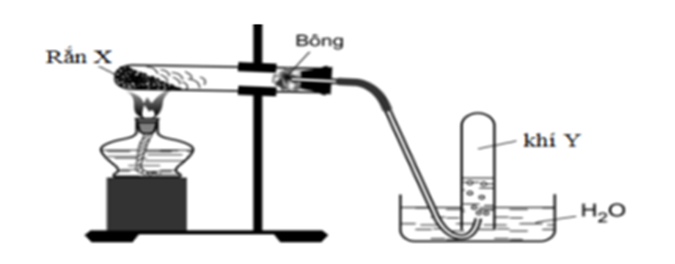
Cho biết X, Y là chất nào? Viết phương trình hóa học của phản ứng xảy ra trong ống nghiệm được đun nóng?
Quảng cáo
Trả lời:
Các chất tương ứng:
|
X |
Y |
PTHH |
|
KMnO4 |
O2 |
2KMnO4 K2MnO4 + MnO2 + O2 |
|
CH3COONa |
CH4 |
CH3COONa + NaOH CH4 + Na2CO3 |
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Phương pháp tách riêng từng khí trong X:
* Cách 1:
- Dẫn hỗn hợp X qua dung dịch NaCl (bão hòa) dư thu được dung dịch A gồm NaCl, HCl và khí B thoát ra gồm O2, SO2. Đun nóng dung dịch A thu được khí HCl thoát ra.
- Dẫn khí B qua dung dịch Ca(OH)2 dư, thu được khí thoát ra là O2, kết tủa CaSO3. Lọc kết tủa, cho tác dụng với H2SO4 thu được SO2 thoát ra.
SO2 + Ca(OH)2 ⟶ CaSO3 + H2O
CaSO3 + H2SO4 ⟶ CaSO4 + SO2 + H2O
* Cách 2:
- Dẫn hỗn hợp khí vào dung dịch Ba(OH)2 dư, thu được oxi không phản ứng thoát ra khỏi dung dịch.
Ba(OH)2 + SO2 ⟶ BaSO3 + H2O
Ba(OH)2 +2HCl ⟶ BaCl2 + 2H2O
- Lọc kết tủa rồi cho phản ứng với dung dịch H2SO4 dư thu được khí SO2.
BaSO3 + H2SO4 ⟶ BaSO4 + SO2 + H2O
- Phần dung dịch còn lại ở trên gồm BaCl2 và Ba(OH)2 dư cho tác dụng với dung dịch H2SO4 dư
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
- Lọc kết tủa, đem cô cạn dung dịch thu được HCl có lẫn hơi nước được dẫn qua bình chứa H2SO4 đặc (dư) thu được khí HCl tinh khiết.
Lời giải
- Khi tác dụng HCl: nHCl phản ứng = = 0,6 mol;
nHCl dư = 0,72 – 0,6 = 0,12 (mol)
CuO + 2HCl → CuCl2 + H2O (1)
FexOy + yHCl → xFeCl2y/x + yH2O (2)
Fe + 2HCl → FeCl2 + H2 (3)
Cu + FeCl3 → CuCl2 + FeCl2 (4)
Fe + 2FeCl3 → 3FeCl2 (5)
- Số mol các chất trong 270,8 gam dung dịch Y
- Trong dung dịch trung hòa về điện (hoặc bảo toàn Cl trong muối) ta có: (*)
- Khi tác dụng H2SO4 đặc, nóng:
CuO + H2SO4 ⟶ CuSO4 + H2O (6)
2FexOy + (6x-2y)H2SO4 ⟶ xFe2(SO4)3 + (6x-2y)H2O + (3x-2y)SO2 (7)
2Fe + 6H2SO4 ⟶ Fe2(SO4)3 + 6H2O + 3SO2 (8)
Cu + 2H2SO4 ⟶ CuSO4 + 2H2O + SO2 (9)
Fe + Fe2(SO4)3 ⟶ 3FeSO4 (10)
Cu + Fe2(SO4)3 ⟶ CuSO4 + 2FeSO4 (11)
- Các chất trong dung dịch Z
- Bảo toàn Fe ta có: (**)
- Khi Z tác dụng dung dịch Ba(OH)2 dư, tách kết tủa rồi nung
FeSO4 + Ba(OH)2 → BaSO4 + Fe(OH)2 (12)
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Fe(OH)3 (13)
CuSO4 + Ba(OH)2 → BaSO4 + Cu(OH)2 (14)
- Kết tủa T
4Fe(OH)2 + O2 2Fe2O3 + 4H2O (15)
2Fe(OH)3 Fe2O3 + 3H2O (16)
Cu(OH)2 CuO + H2O (17)
- Theo phương trình hóa học (1, 2, 3):
- Theo phương trình hóa học (6,7,8,9):
- Bảo toàn S: số mol gốc SO42- trong muối = = 0,42 – 0,09 = 0,33 (mol)
- Bảo toàn S, Fe, Cu: chất rắn còn lại (99,29 gam) gồm
⇒ 99,29 = 0,33.233 + 80(d +2e) + 80c (***)
- Thay (**) vào (***) ta có: 80(a + b) + 80c = 22,4 (****)
- Từ (*) và (****) ta có: a = 0,04 (mol)
- Phần trăm khối lượng FeCl3 trong dung dịch Y:
.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.