Thí nghiệm 1. Xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím)
Chuẩn bị:
- Hoá chất: Dung dịch thuốc tím KMnO4 có nồng độ chính xác 0,02 M, dung dịch FeSO4 có nồng độ khoảng 0,1 M; dung dịch H2SO4 20%.
- Dụng cụ : Burette loại 25 mL, bình tam giác loại 100 mL.
Tiến hành:
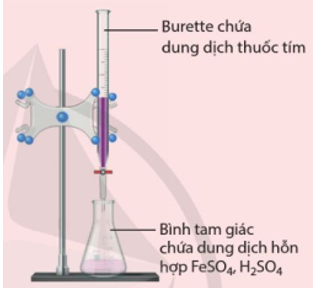
Hình 20.1. Bộ dụng cụ thí nghiệm chuẩn độ muối FeSO4 trong môi trường acid bằng dung dịch thuốc tím
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0, đồng thời bảo đảm không còn bọt khí trong burette. Cho 10 mL dung dịch FeSO4 và 5 mL dung dịch H2SO4 20% vào bình tam giác.
- Mở khoá để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình.
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khoá burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng.
Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO4. Biết phương trình hoá học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe2+(aq) + (aq) + 8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H₂O(1)
Thí nghiệm 1. Xác định nồng độ của dung dịch FeSO4 bằng dung dịch KMnO4 (dung dịch thuốc tím)
Chuẩn bị:
- Hoá chất: Dung dịch thuốc tím KMnO4 có nồng độ chính xác 0,02 M, dung dịch FeSO4 có nồng độ khoảng 0,1 M; dung dịch H2SO4 20%.
- Dụng cụ : Burette loại 25 mL, bình tam giác loại 100 mL.
Tiến hành:

Hình 20.1. Bộ dụng cụ thí nghiệm chuẩn độ muối FeSO4 trong môi trường acid bằng dung dịch thuốc tím
- Lắp bộ dụng cụ như Hình 20.1. Cho dung dịch thuốc tím vào burette đến vạch 0, đồng thời bảo đảm không còn bọt khí trong burette. Cho 10 mL dung dịch FeSO4 và 5 mL dung dịch H2SO4 20% vào bình tam giác.
- Mở khoá để nhỏ từ từ từng giọt dung dịch thuốc tím vào bình tam giác, đồng thời lắc đều bình.
- Tiếp tục nhỏ dung dịch thuốc tím (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình tam giác xuất hiện màu hồng nhạt bởi một giọt thuốc tím dư, không mất màu trong khoảng 20 giây thì kết thúc chuẩn độ (khoá burette).
- Ghi lại thể tích dung dịch thuốc tím đã dùng.
Lặp lại thí nghiệm ít nhất hai lần nữa.
Yêu cầu: Xác định nồng độ của dung dịch FeSO4. Biết phương trình hoá học của phản ứng diễn ra trong quá trình chuẩn độ là:
5Fe2+(aq) + (aq) + 8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H₂O(1)
Quảng cáo
Trả lời:
Gọi thể tích dung dịch KMnO4 đã dùng ở các lần đo lần lượt là V1, V2, …, Vn
Ta có thể tích trung bình của dung dịch KMnO4 là:
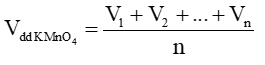
Theo phương trình chuẩn độ, ta có:
⇒
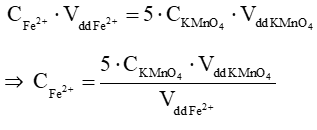
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- 500 Bài tập tổng ôn Hóa học (Form 2025) ( 38.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Số oxi hóa của Fe trong FeO là +2.
Số oxi hóa của Fe trong Fe2O3 là +3.
Số oxi hóa của Fe trong Fe3O4 là +8/3 (hay +2 và + 3).
Lời giải
Phương trình hóa học:
5Fe2+(aq) + (aq) + 8H+(aq) →5Fe3+(aq) + Mn2+(aq) + 4H₂O(1)
Ta có:
Theo phương trình: ![]() = 5 . 1,08 . 10-4 = 5,4 . 10-4 (mol)
= 5 . 1,08 . 10-4 = 5,4 . 10-4 (mol)
a) Khối lượng sắt có trong mẫu chất là: 56 . 5,4 . 10-4 = 0,03024 (g) = 30,24 (mg)
b) Ta có: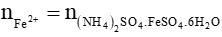 = 5,4 . 10-4 (mol)
= 5,4 . 10-4 (mol)
⇒
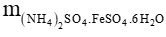 = 392 . 5,4 . 10-4 = 0,21168 (g)
= 392 . 5,4 . 10-4 = 0,21168 (g)
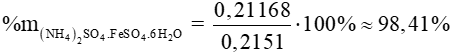
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.