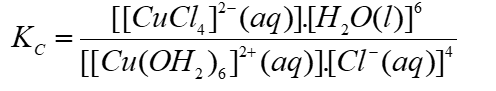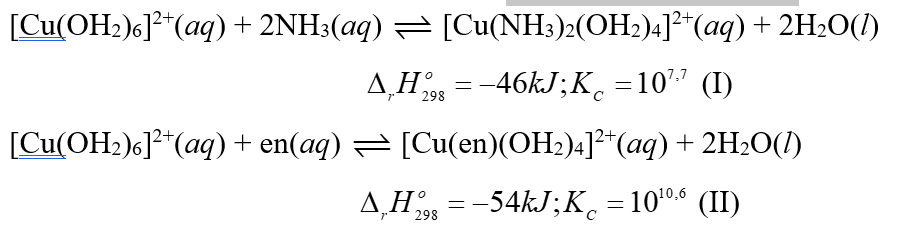Giải SBT Hóa 12 Cánh diều Bài 22: Sơ lược về sự hình thành phức chất của ion kim loại chuyển tiếp trong dung dịch có đáp án
58 người thi tuần này 4.6 732 lượt thi 15 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Chân trời sáng tạo cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 2
Bộ 3 đề thi cuối kì 2 Hóa 12 Cánh diều cấu trúc mới có đáp án - Đề 1
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 3
Bộ 3 đề thi cuối kì 2 Hóa 12 Kết nối tri thức cấu trúc mới có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
Đáp án đúng là: C
Khi tan trong nước, muối của các kim loại chuyển tiếp phân li thành các ion. Sau đó, cation kim loại chuyển tiếp (Mn+) thường nhận các cặp electron hoá trị riêng từ các phân tử H2O để hình thành các liên kết cho - nhận, tạo ra phức chất aqua có dạng tổng quát là [M(OH2)m]n+.
Câu 2
Khi cho dung dịch ammonia dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ và anion Cl- thì có phản ứng sau:
[Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l) (*)
Phát biểu nào dưới đây là không đúng?
A. Trong điều kiện của phản ứng (*), phức chất [Ni(NH3)6]2+(aq) kém bền hơn phức chất [Ni(OH2)6]2+(aq).
B. Phản ứng (*) là phản ứng thế phối tử.
C. Dung dịch sau phản ứng có pH > 7.
D. Trong phản ứng không có sự thay đôi số oxi hoá của các nguyên tố.
Khi cho dung dịch ammonia dư vào dung dịch chứa phức chất [Ni(OH2)6]2+ và anion Cl- thì có phản ứng sau:
[Ni(OH2)6]2+(aq) + 6NH3(aq) → [Ni(NH3)6]2+(aq) + 6H2O(l) (*)
Phát biểu nào dưới đây là không đúng?
A. Trong điều kiện của phản ứng (*), phức chất [Ni(NH3)6]2+(aq) kém bền hơn phức chất [Ni(OH2)6]2+(aq).
B. Phản ứng (*) là phản ứng thế phối tử.
C. Dung dịch sau phản ứng có pH > 7.
D. Trong phản ứng không có sự thay đôi số oxi hoá của các nguyên tố.
Lời giải
Đáp án đúng là: A
Trong điều kiện của phản ứng (*), phức chất [Ni(NH3)6]2+(aq) bền hơn phức chất [Ni(OH2)6]2+(aq).
Câu 3
Nước có lượng đáng kể các cation Al3+ và Fe3+ được gọi là nước nhiễm phèn. Trong nước nhiễm phèn, mỗi cation này bị thuỷ phân tạo thành phức chất gồm 1 nguyên tử trung tâm, 3 phối tử OH- và 3 phối từ H2O.
a) Viết phương trình hoá học của các phản ứng diễn ra.
b) Vì sao nước phèn có pH thấp?
c) Vì sao trong nước phèn xuất hiện các chất lơ lửng không tan?
Nước có lượng đáng kể các cation Al3+ và Fe3+ được gọi là nước nhiễm phèn. Trong nước nhiễm phèn, mỗi cation này bị thuỷ phân tạo thành phức chất gồm 1 nguyên tử trung tâm, 3 phối tử OH- và 3 phối từ H2O.
a) Viết phương trình hoá học của các phản ứng diễn ra.
b) Vì sao nước phèn có pH thấp?
c) Vì sao trong nước phèn xuất hiện các chất lơ lửng không tan?
Lời giải
a) Phương trình hóa học:
Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+(aq);
[Al(OH2)6]3+(aq) [Al(OH)3(OH2)3](s) + 3H+(aq)
Fe3+(aq) + 6H2O(l) → [Fe(OH2)6]3+(aq);
[Fe(OH2)6]3+(aq) [Fe(OH)3(OH2)3](s) + 3H+(aq)
b) Vì các phản ứng tạo phức xảy ra hình thành H+ tạo môi trường acid → pH thấp.
c) Đó là các sản phẩm phức [Al(OH)3(OH2)3] và [Fe(OH)3(OH2)3]. Phức chất này có dạng keo nên kết dính phù sa, cặn bã … trong nước.
Lời giải
Nguyên nhân của ứng dụng trên là dựa vào phản ứng tạo phức của cation Co2+ trong dung dịch:
CoCl2(s) + 6H2O(l) → [Co(OH2)6]2+(aq) + 2Cl- (aq) (*)
Khi sấy khô băng giấy xảy ra phản ứng hóa học ngược với phản ứng (*) tạo CoCl2 có màu hồng.
Khi băng giấy màu hồng tiếp xúc với mẫu vật có nước thì lại diễn ra quá trình (*) làm băng giấy chuyển sang màu xanh.
Câu 5
Mỗi phát biểu dưới đây đúng hay sai?
(a) Trong nước, cation của kim loại M (có hoá trị n) thường tồn tại ở dạng phức chất aqua [M(OH2)m]n+.
(b) Các phức chất aqua [M(OH2)m]n+ luôn có màu.
(c) Trong nhiều phức chất aqua [M(OH2)m]n+, số phối tử thường là 6.
(d) Phức chất aqua [M(OH2)m]n+ có thể tan hoặc không tan trong nước.
Mỗi phát biểu dưới đây đúng hay sai?
(a) Trong nước, cation của kim loại M (có hoá trị n) thường tồn tại ở dạng phức chất aqua [M(OH2)m]n+.
(b) Các phức chất aqua [M(OH2)m]n+ luôn có màu.
(c) Trong nhiều phức chất aqua [M(OH2)m]n+, số phối tử thường là 6.
(d) Phức chất aqua [M(OH2)m]n+ có thể tan hoặc không tan trong nước.
Lời giải
(a) Đúng
(b) Sai. Có một số cation kim loại không có màu trong dung dịch.
(c) Đúng.
(d) Sai. Phức chất aqua tan trong nước
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 10
Có hai thí nghiệm dưới đây.
Thí nghiệm 1 ở 0°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
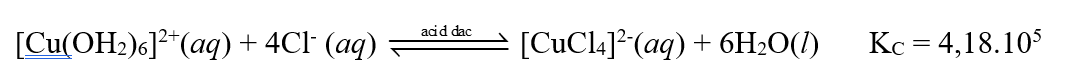
Thí nghiệm 2 ở 20°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
Mỗi phát biểu sau đây đúng hay sai?
(a) Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
Có hai thí nghiệm dưới đây.
Thí nghiệm 1 ở 0°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc không màu vào ống nghiệm đó thì thu được dung dịch có màu vàng chanh do có quá trình:
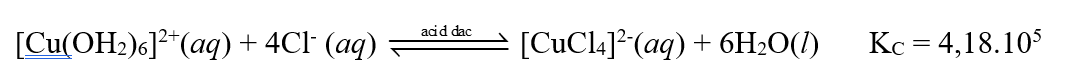
Thí nghiệm 2 ở 20°C: Có một ống nghiệm chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hoà không màu vào ống nghiệm đó thì thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
Mỗi phát biểu sau đây đúng hay sai?
(a) Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là:
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 11
Khi hoà tan một lượng phèn nhôm - kali vào nước thì có các quá trình cơ bản sau diễn ra:
Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+(aq) (1)
[Al(OH2)6]3+(aq) + 3H2O(l) [Al(OH)3(H2O)3](s) + 3H3O+(aq) (2)
Mỗi phát biểu sau đây là đúng hay sai?
(a) Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trình này diễn ra rất thuận lợi.
(b) Các quá trình (1) và (2) giúp giải thích vì sao cation Al3+ là một base trong dung dịch nước theo Bronsted – Lowry.
(c) Ở quá trình (2), các phân tử nước đóng vai trò là dung môi.
(d) Để thu được nhiều kết tủa keo thì cần hoà tan lượng nhỏ phèn trong lượng lớn nước.
Khi hoà tan một lượng phèn nhôm - kali vào nước thì có các quá trình cơ bản sau diễn ra:
Al3+(aq) + 6H2O(l) → [Al(OH2)6]3+(aq) (1)
[Al(OH2)6]3+(aq) + 3H2O(l) [Al(OH)3(H2O)3](s) + 3H3O+(aq) (2)
Mỗi phát biểu sau đây là đúng hay sai?
(a) Quá trình (1) là quá trình tạo phức chất aqua của cation Al3+. Quá trình này diễn ra rất thuận lợi.
(b) Các quá trình (1) và (2) giúp giải thích vì sao cation Al3+ là một base trong dung dịch nước theo Bronsted – Lowry.
(c) Ở quá trình (2), các phân tử nước đóng vai trò là dung môi.
(d) Để thu được nhiều kết tủa keo thì cần hoà tan lượng nhỏ phèn trong lượng lớn nước.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 12
Phèn sắt - ammonium là muối kép có công thức (NH4)2SO4.Fe2(SO4)3.24H2O thường được dùng làm chất cầm màu vải, xử lí nước thải công nghiệp,... Khi hoà tan một lượng nhỏ phèn sắt - ammonium vào nước, sẽ có phản ứng thủy phân diễn ra, thu được phức chất không tan chứa phối tử H2O và OH- và phần dung dịch.
a) Viết các phương trình hoá học của quá trình tạo phức chất không tan.
b) Nêu cách chứng minh sự có mặt của tất cả các ion có trong phần dung dịch.
Phèn sắt - ammonium là muối kép có công thức (NH4)2SO4.Fe2(SO4)3.24H2O thường được dùng làm chất cầm màu vải, xử lí nước thải công nghiệp,... Khi hoà tan một lượng nhỏ phèn sắt - ammonium vào nước, sẽ có phản ứng thủy phân diễn ra, thu được phức chất không tan chứa phối tử H2O và OH- và phần dung dịch.
a) Viết các phương trình hoá học của quá trình tạo phức chất không tan.
b) Nêu cách chứng minh sự có mặt của tất cả các ion có trong phần dung dịch.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 13
Cho các quá trình tạo phức chất bát diện sau:
![Cho các quá trình tạo phức chất bát diện sau: Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/08/blobid4-1724945356.png)
Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu.
Mỗi phát biểu sau đây đúng hay sai?
(a) Quá trình (I) xảy ra khi hoà tan iron(III) chloride trong nước. Kết thúc quá trình này thu được dung dịch có chứa lượng lớn cation Fe3+ và phức chất aqua [Fe(OH2)6]3+.
(b) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH)6]3+ hơn.
(c) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu.
(d) Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
Cho các quá trình tạo phức chất bát diện sau:
![Cho các quá trình tạo phức chất bát diện sau: Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/08/blobid4-1724945356.png)
Biết dung dịch [Fe(OH2)6]3+ màu vàng nâu, dung dịch [Fe(OH2)5(SCN)]2+ có màu đỏ, dung dịch [Fe(OH2)5F]2+ và các anion SCN-, F- đều không có màu.
Mỗi phát biểu sau đây đúng hay sai?
(a) Quá trình (I) xảy ra khi hoà tan iron(III) chloride trong nước. Kết thúc quá trình này thu được dung dịch có chứa lượng lớn cation Fe3+ và phức chất aqua [Fe(OH2)6]3+.
(b) So với anion F-, anion SCN- dễ thay thế phối tử H2O trong [Fe(OH)6]3+ hơn.
(c) Khi cho từ từ dung dịch KSCN vào dung dịch ở quá trình (III) thì dung dịch này sẽ có màu.
(d) Trong các quá trình (I), (II) và (III), mỗi phân tử H2O hoặc anion SCN- hay anion F- đều sử dụng số cặp electron hoá trị riêng như nhau để cho vào orbital trống của cation Fe3+.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 15
Khi hòa tan zinc(II)chloride trong nước, diễn ra một số quá trình cơ bản sau:
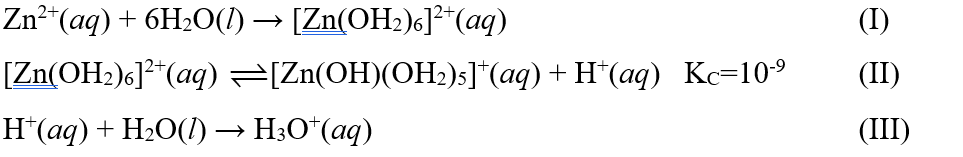
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Bronsted - Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Bronsted - Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Bronsted - Lowry.
Số phát biểu đúng là:
A. 2. B. 3. C. 4. D 5
Khi hòa tan zinc(II)chloride trong nước, diễn ra một số quá trình cơ bản sau:
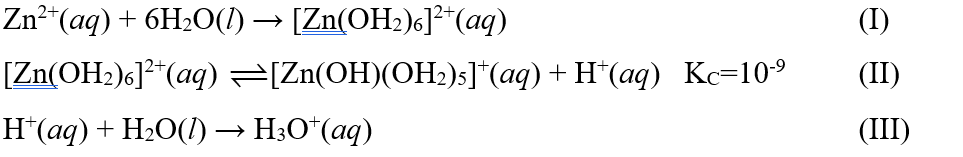
Cho các phát biểu sau:
(1) Quá trình (I) và (III) có thể diễn ra yếu hơn quá trình (II).
(2) Từ quá trình (II) có thể suy ra “[Zn(OH2)6]2+ là acid theo Arrhenius”.
(3) Từ quá trình (III) có thể suy ra “H2O là base theo Bronsted - Lowry”.
(4) Từ quá trình (I), (II) và (III) suy ra “trong nước, cation Zn2+ là acid theo Bronsted - Lowry”.
(5) Dung dịch zinc(II) chloride có tính acid khá mạnh.
(6) Trong dung dịch zinc(II) chloride, nước vừa là dung môi, vừa đóng vai trò base theo Bronsted - Lowry.
Số phát biểu đúng là:
A. 2. B. 3. C. 4. D 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.