Chia 16 gam hỗn hợp A gồm Fe, Cu và CuO thành 2 phần bằng nhau:
- Phần 1: tác dụng vừa đủ với 150 ml dung dịch H2SO40,5M, thu được khí H2.
- Phần 2: tác dụng với 49 gam dung dịch H2SO475% (lấy dư), đun nóng, thu được dung dịch B và khí SO2(sản phẩm khử duy nhất). Cô cạn dung dịch B thu được 22 gam muối khan.
a. Tính phần trăm khối lượng mỗi chất trong hỗn hợp A.
b. Lượng axit dư trong dung dịch B có thể hòa tan tối đa 3,25 gam kim loại M (hóa trị II), thu được khí SO2 (sản phẩm khử duy nhất). Xác định tên kim loại M.
c. Hấp thụ hoàn toàn lượng khí SO2 ở phần 2 bằng một lượng vừa đủ dung dịch Br2 thu được dung dịch X. Trung hòa dung dịch X cần dùng bao nhiêu gam dung dịch KOH 28%?
Câu hỏi trong đề: Bộ 7 Đề thi Học kì 2 Hóa 10 cực hay có đáp án !!
Quảng cáo
Trả lời:
Gọi số mol của Fe, Cu và CuO lần lượt là x (mol), y (mol), z (mol).
Phần 1:
Vì phản ứng tạo ra khí H2nên dung dịch H2SO4loãng ⇒ Chỉ có Fe và CuO phản ứng. Ta có PTHH
Fe + H2SO4→ FeSO4+ H2
x x
CuO + H2SO4→ CuSO4+ H2O
y y
Theo phương tình ta có: x + z = 0,075 (1)
Phần 2:
Vì phản ứng tạo khí SO2nên dung dịch H2SO4 đặc ⇒ Có Fe, Cu và CuO phản ứng. Ta có PTHH
2Fe + 6H2SO4→ Fe2(SO4)3+ 3SO2+ 6H2O
x
Cu + 2H2SO4→ CuSO4+ SO2+ 2H2O
y y
CuO + H2SO4→ CuSO4+ H2O
z z
Cô cạn dụng dịch được 26 gam muối khan.
⇒ 200x + 160y + 160z = 22 gam ( 2)
Ta có: 56x + 64y + 80z = 10 gam (3)
Từ (1), (2) và (3) ta có hệ phương trình:
a.
b.
= 0,375 – ( 3.0,05 + 2.0,05 + 0,025) = 0,1 mol
M + 2H2SO4→ MSO4+ SO2+ 2H2O
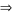 nM= 0,05 mol
nM= 0,05 mol 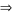 M = = 65
M = = 65 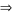 M là Zn
M là Zn
c.
= .0,05 + 0,05 = 0,125 mol
SO2+ Br2+ 2H2O → H2SO4+ 2HBr
0,125 →0,1250,25
2KOH + H2SO4→ K2SO4+ 2H2O
KOH + HBr → KBr + H2O
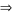 nKOH= 0,125.2 + 0,25 = 0,5 mol
nKOH= 0,125.2 + 0,25 = 0,5 mol
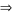 mddKOH= = 100 gam
mddKOH= = 100 gam
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là:
⇒ Tạo muối Na2SO3và NaHSO3
Đặt số mol Na2SO3và NaHSO3lần lượt là x và y
Theo bài ra ta có hệ phương trình:
mdd sau pư = + mNaOH = 0,2.64 + 160 = 172,8g
Lời giải
a. Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh ⇒ H2SO4
+ Y là muối trung hòa của kim loại natri ⇒Na2SO3
+ Z là khí không màu, có mùi hắc ⇒SO2
b. Na2SO3+ H2SO4Na2SO4 + SO2 + H2O
c. Khi sục SO2vào dung dịch H2S thì xảy ra hiện tượng là dung dịch bị vẩn đục màu vàng (S). PTHH:
SO2+ 2H2S → 3S↓ + 2H2O
2.
a. Ta có
b.
- Thay 26 gam kẽm hạt bằng 26 gam kẽm bột thì tốc độ phản ứng tăng lên do tăng diện tích bề mặt. Kẽm bột phản ứng với axit nhanh hơn kẽm hạt.
- Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 60oC) thì tốc độ phản ứng tăng lên do tăng nhiệt độ.
- Dùng thể tích dung dịch H2SO4gấp đôi lượng ban đầu thì tốc độ phản ứng không thay đổi vì thể tích không ảnh hưởng đến tốc độ phản ứng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
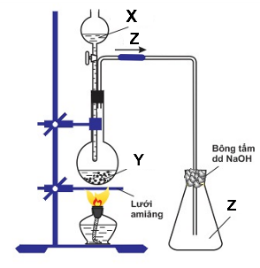 Với X, Y, Z là các hợp chất của lưu huỳnh:
Với X, Y, Z là các hợp chất của lưu huỳnh: