Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8)
b) Li (Z = 3) và F (Z = 9)
c) Mg (Z = 12) và P (Z = 15)
Hãy dự đoán xu hướng nhường, nhận electron của mỗi nguyên tử trong từng cặp nguyên tử sau. Vẽ sơ đồ (hoặc viết số electron theo lớp) quá trình các nguyên tử nhường, nhận electron để tạo ion.
a) K (Z = 19) và O (Z = 8)
b) Li (Z = 3) và F (Z = 9)
c) Mg (Z = 12) và P (Z = 15)
Câu hỏi trong đề: Bài tập Quy tắc octet có đáp án !!
Quảng cáo
Trả lời:
a) K (Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1. Vậy K có 1 electron lớp vỏ ngoài cùng. Nguyên tử K có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là K+.
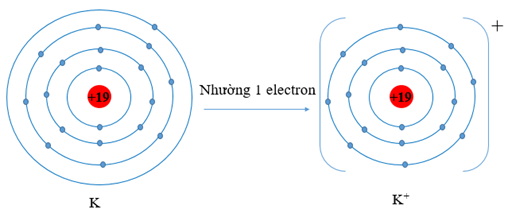
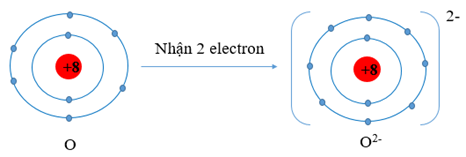
O (Z = 8) có cấu hình electron là 1s22s22p4. Vậy O có 6 electron lớp vỏ ngoài cùng nên nguyên tử O có xu hướng nhận thêm 2 electron để trở thành ion mang điện tích âm, kí hiệu là O2-
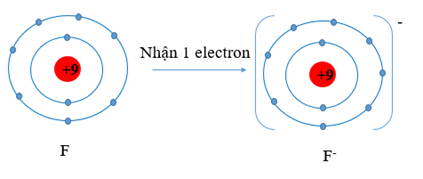
b) Li (Z = 3) có cấu hình electron là: 1s22s1. Vậy Li có 1 electron lớp vỏ ngoài cùng. Nguyên tử Li có xu hướng nhường đi 1 electron để trở thành ion mang điện tích dương, kí hiệu là Li+.

F (Z = 9) có cấu hình electron là: 1s22s22p5. Vậy F có 7 electron lớp vỏ ngoài cùng. Nguyên tử F có xu hướng nhận thêm 1 electron để trở thành ion mang điện tích âm, kí hiệu là F-.
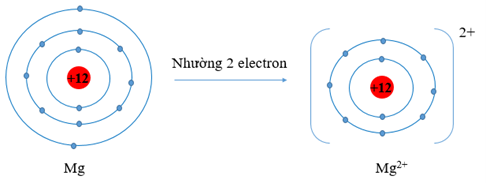
c) Mg (Z = 12) có cấu hình electron là: 1s22s22p63s2. Vậy Mg có 2 electron lớp vỏ ngoài cùng. Nguyên tử Mg có xu hướng nhường đi 2 electron để trở thành ion mang điện tích dương, kí hiệu là Mg2+.
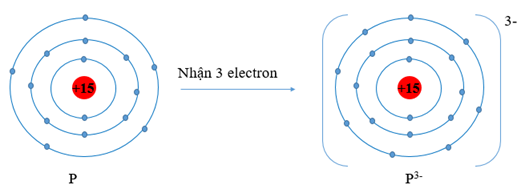
P (Z = 15) có cấu hình electron là: 1s22s22p63s23p3. Vậy P có 5 electron lớp vỏ ngoài cùng. Nguyên tử P có xu hướng nhận thêm 3 electron để trở thành ion mang điện tích âm, kí hiệu là P3-.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Ta có, mỗi gạch trong các công thức H-C≡C-H, H2C=CH2 và H3C-CH3 biểu diễn hai electron hóa trị chung, do đó mỗi C đã đủ 8 electron ở lớp ngoài cùng; mỗi H đã đủ 2 electron ở lớp ngoài cùng (thõa mãn quy tắc octet).
b) Một phân tử hydrocarbon có ba nguyên tử C và x nguyên tử H.
Phân tử hydrocarbon có dạng: C3Hx
- Số các nguyên tử có hoá trị ≥ 2 là 3 (tức 3 C) ⇒ tổng số electron hoá trị là 3.4 = 12.
- Tổng số liên kết đơn giữa các nguyên tử có hoá trị ≥ 2 là: 3 – 1 = 2 ⇒ tổng số electron tham gia tạo liên kết là 2.2 = 4.
- Số H tối đa: x = 12 – 4 = 8.
Lời giải
Đáp án B
A. Boron (Z = 5): 1s22s22p1
Boron có 3 electron lớp ngoài cùng nên có xu hướng nhường đi 3 electron này khi hình thành liên kết hóa học.
B. Potassium (Z = 19): 1s22s22p63s23p64s1
Potassium có 1 electron lớp ngoài cùng nên có xu hướng nhường đi 1 electron này khi hình thành liên kết hóa học.
C. Helium (Z = 2): 1s2
Helium đã có cấu hình electron bền vững nên không nhường hoặc nhận electron.
D. Fluorine (Z = 9): 1s22s22p5
Fluorine có 7 electron lớp ngoài cùng nên có xu hướng nhận thêm 1 electron khi hình thành liên kết hóa học.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.