Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.
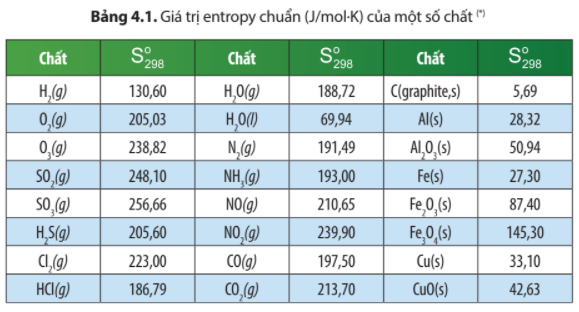
Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:
a) SO3(g) → SO2(g) + O2(g)
và so sánh giá trị của phản ứng này với phản ứng ở ví dụ 1. Giải thích.
b) C(graphite, s) + O2(g) → CO2(g)
Giải thích tại sao giá trị này lại lớn hơn 0 không đáng kể.

Quảng cáo
Trả lời:
=
= × (O2, g) + (SO2, g) - (SO3, g)
= × 205,03 + 248,10 – 256,66 = 93,955 J/K > 0
⇒ Phản ứng phân hủy SO3 làm tăng độ mất trật tự của hệ.
Ở ví dụ 1, phản ứng tổng hợp SO3 có = -93,95 J/K < 0
⇒ Phản ứng làm giảm độ mất trật tự của hệ.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Hòa tan vôi sống (CaO) vào nước là phản ứng tỏa nhiệt
∆H của phản ứng mang dấu âm hay ∆H < 0.
Lời giải
= (CO, g) + × (O2, g) - (CO2, g)
= -110,05 + × 0 – (–393,51) = 283,46 (kJ)
= × (O2, g) + (CO, g) - (CO2, g)
= × 205,03 + (-197,50) - 213,69 = -308,675 J/K
= - 298.
= 283,46.103 – 298. (-308,675) = 375445,15 J > 0
⇒ Phản ứng trên không tự xảy ra.
b) Để phản ứng trên tự xảy ra, cần có:
= - T. < 0
⇔ 283,46.103 – T. (-308,675) < 0
⇔ T > 918 K hay T > 645 oC
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.