Bài 33: Điều chế khí hidro - Phản ứng thế
20 người thi tuần này 4.6 11.3 K lượt thi 5 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 18)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 17)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 16)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 15)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 14)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 13)
Đề kiểm tra giữa học kì 2 Hóa học 8 có đáp án (Mới nhất) (Đề 12)
Đề kiểm tra cuối kì 2 Hóa 8 có đáp án (Mới nhất) (Đề 17)
Danh sách câu hỏi:
Lời giải
Phản ứng hóa học điều chế H2 trong phòng thí nghiệm là: a) và c)
Lời giải
Phản ứng a) 2Mg + O2 → 2MgO. Phản ứng oxi hóa khử ( phản ứng hóa hợp).
Phản ứng b) là phản ứng oxi- hóa khử (phản ứng phân hủy).
Phản ứng c) là phản ứng thế.
Lời giải
Vì khí O2 (M =32) nặng hơn không khí (M=29) nên khi thu khí oxi ta có thể để ống nghiệm nghiêng hoặc để đứng còn khí H2 nhẹ hơn không khí nên khi thu khí phải úp ngược ống nghiệm không được để đứng ống nghiệm.
Lời giải
Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.
Lời giải
Phương trình hóa học của phản ứng:
So sánh tỉ lệ 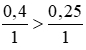
Theo PT nFe (pư) = nH2SO4 = 0,25 mol ⇒ nFe dư = 0,4 – 0,25 = 0,15 mol
mFe dư = 0,15. 56 = 8,4g.
Do khối lượng Fe dư nên tính thể tích khí H2 theo số mol H2SO4.
nH2 = nH2SO4 = 0,25 mol
Vkhí = 0,25 . 22,4 = 5,6l.