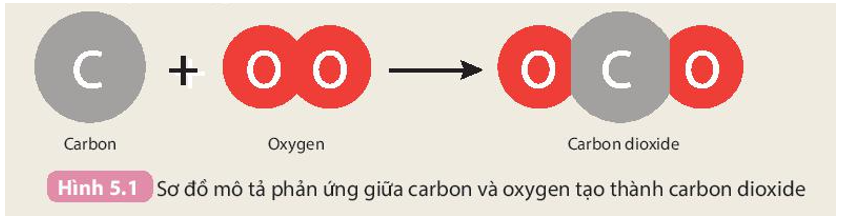
Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm nào? Nêu ý nghĩa của phương trình hoá học.
Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm nào? Nêu ý nghĩa của phương trình hoá học.
Quảng cáo
Trả lời:
- Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm: sơ đồ hoá học chưa cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng.
- Ý nghĩa của phương trình hoá học: Phương trình hoá học cho biết trong phản ứng hoá học, lượng các chất tham gia phản ứng và các chất sản phẩm tuân theo một tỉ lệ xác định.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Văn - Sử - Địa - GDCD lớp 8 (chương trình mới) ( 60.000₫ )
- Trọng tâm Toán, Anh, KHTN lớp 8 (chương trình mới) ( 60.000₫ )
- Trọng tâm Văn - Sử - Địa - GDCD và Toán - Anh - KHTN lớp 8 (chương trình mới) ( 120.000₫ )
- Trọng tâm Toán - Văn - Anh, Toán - Anh - KHTN lớp 6 (chương trình mới) ( 126.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
a) Fe + O2 − − → Fe3O4
Số nguyên tử Fe và O ở hai vế không bằng nhau, nhưng O có số nguyên tử nhiều hơn nên ta bắt đầu từ nguyên tố này trước. Do O2 có 2 nguyên tử O còn Fe3O4 có 4 nguyên tử O nên ta đặt hệ số 2 trước O2; để cân bằng tiếp số nguyên tử Fe ta đặt hệ số 3 vào trước Fe ở vế trái. Phương trình hoá học của phản ứng hoàn thiện như sau:
3Fe + 2O2 → Fe3O4.
b) Al + HCl − − → AlCl3 + H2
Trước phản ứng có 1 nguyên tử H và 1 nguyên tử Cl trong phân tử HCl; sau phản ứng có 3 nguyên tử Cl trong AlCl3; 2 nguyên tử H trong phân tử H2, do đó ta lấy bội chung nhỏ nhất của 3 và 2 là 6, đặt trước HCl, được:
Al + 6HCl − − → AlCl3 + H2
Để cân bằng số nguyên tử H ta đặt hệ số 3 trước H2; để cân bằng số nguyên tử Cl ta đặt hệ số 2 trước AlCl3, được:
Al + 6HCl − − → 2AlCl3 + 3H2
Cuối cùng để cân bằng số nguyên tử Al ta thêm hệ số 2 trước Al ở vế trái. Phương trình hoá học của phản ứng được hoàn thiện như sau:
2Al + 6HCl → 2AlCl3 + 3H2
c) Al2(SO4)3 + NaOH − − → Al(OH)3 + Na2SO4
Trước tiên ta cân bằng nhóm (SO4) bằng cách đặt hệ số 3 vào trước Na2SO4:
Al2(SO4)3 + NaOH − − → Al(OH)3 + 3Na2SO4
Để cân bằng tiếp số nguyên tử Na ta thêm hệ số 6 vào trước NaOH.
Al2(SO4)3 + 6NaOH − − → Al(OH)3 + 3Na2SO4
Cuối cùng thêm hệ số 2 trước Al(OH)3 để đảm bảo cân bằng số nguyên tử Al và nhóm (OH), khi đó phương trình hoá học được thiết lập:
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
d) CaCO3 + HCl − − → CaCl2 + CO2 + H2O
Ta thấy trước phản ứng có 1 nguyên tử H; 1 nguyên tử Cl trong phân tử HCl; Sau phản ứng có 2 nguyên tử Cl trong CaCl2; 2 nguyên tử H trong H2O. Để cân bằng số nguyên tử H và Cl ta thêm hệ số 2 trước HCl.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Kiểm tra lại thấy các nguyên tử đã được cân bằng, phương trình hoá học được hoàn thiện.
Lời giải
Ta có bảng sau:
|
Nguyên tử/ nhóm nguyên tử |
Na |
(CO3) |
Ba |
(OH) |
|
Trước phản ứng (số lượng) |
2 |
1 |
1 |
2 |
|
Sau phản ứng (số lượng) |
1 |
1 |
1 |
1 |
Như vậy để cân bằng số nguyên tử Na và nhóm (OH), chỉ cần thêm hệ số 2 trước NaOH. Khi đó phương trình hoá học cũng đã được thiết lập:
Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
Ta có tỉ lệ: Số phân tử Na2CO3 : Số phân tử Ba(OH)2 : Số phân tử BaCO3 : Số phân tử NaOH = 1 : 1 : 1 : 2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.