Đầu thế kỉ XX, các kết quả nghiên cứu vể cơ học lượng tử đã góp phẩn làm rõ hơn bản chẩt của liên kết hoá học trong các phân tử. Nhờ đó, bản chất liên kết trong phức chất cùng được làm rõ hơn bởi thuyết Liên kết hoá trị (VB, valence bond). Thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất như thế nào? Các phức chất có dạng hình học xác định không? Phức chất có những loại đồng phân nào?
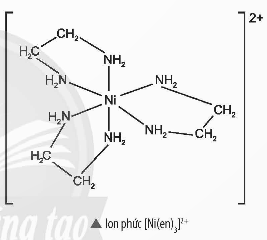
Đầu thế kỉ XX, các kết quả nghiên cứu vể cơ học lượng tử đã góp phẩn làm rõ hơn bản chẩt của liên kết hoá học trong các phân tử. Nhờ đó, bản chất liên kết trong phức chất cùng được làm rõ hơn bởi thuyết Liên kết hoá trị (VB, valence bond). Thuyết Liên kết hoá trị mô tả sự hình thành liên kết trong phức chất như thế nào? Các phức chất có dạng hình học xác định không? Phức chất có những loại đồng phân nào?

Quảng cáo
Trả lời:
- Theo thuyết Liên kết hoá trị, liên kết trong phức chất được hình thành do các phối tử cho cặp electron chưa liên kết vào các orbital lai hoá trống của nguyên tử trung tâm. Kiểu lai hoá các orbital của nguyên tử trung tâm quyết định dạng hình học cùa phức chất.
- Các phức chất có dạng hình học xác định, dạng hình học của phức chất được xác định bằng thực nghiệm. Phức chất loại [ML4]* thường có dạng hình học tứ diện hoặc vuông phẳng. Phức chất loại [ML6]* thường có dạng bát diện.
- Phức chất có các loại đồng phân khác nhau, trong đó có một số loại cơ bản là đồng phân cis - trans, đổng phân ion hoá và đông phân liên kết.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 20 Bộ đề, Tổng ôn, sổ tay, 1200 câu lý thuyết môn Hóa học (có đáp án chi tiết) ( 60.000₫ )
- 20 đề thi tốt nghiệp môn Hóa học (có đáp án chi tiết) ( 45.000₫ )
- Sổ tay lớp 12 các môn Toán, Lí, Hóa, Văn, Sử, Địa, KTPL (chương trình mới) ( 36.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Trong ion phức [Cu(H2O)6]2+ có 6 liên kết cho – nhận giữa 6 phối tử H2O với nguyên tử trung tâm Cu2+ (có cấu hình electron [Ar]3d9). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử H2O và 1 orbital lai hoá sp3d2 trống của ion Cu2+.
![Mô tả sự hình thành liên kết trong ion phức [Cu(H2O)6]2+. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid2-1721485880.png)
Lời giải
a) Trong ion phức [Fe(H2O)6]3+ có 6 liên kết cho – nhận giữa 6 phối tử H2O với nguyên tử trung tâm Fe3+ (có cấu hình electron [Ar]3d5). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử H2O và 1 orbital lai hoá sp3d2 trống của ion Fe3+.
![Mô tả sự hình thành liên kết, biểu diễn dạng hình học của các ion phức chất sau: a) Phức chất bát diện [Fe(H2O)6]3+; b) Phức chất tứ diện [CoBr4]2-. (ảnh 1)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid7-1721486020.png)
b) Trong ion phức [CoBr4]2- có 4 liên kết cho – nhận giữa 4 phối tử Br− với nguyên tử trung tâm Co2+ (có cấu hình electron [Ar]3d7). Mỗi liên kết cho – nhận được hình thành bởi 1 cặp electron chưa liên kết của phối tử Br− và 1 orbital lai hoá sp3 trống của ion Co2+.
![Mô tả sự hình thành liên kết, biểu diễn dạng hình học của các ion phức chất sau: a) Phức chất bát diện [Fe(H2O)6]3+; b) Phức chất tứ diện [CoBr4]2-. (ảnh 2)](https://video.vietjack.com/upload2/quiz_source1/2024/07/blobid8-1721486022.png)
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.