3.2. SUY LUẬN KHOA HỌC
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 103 đến 105:
Theo thuyết va chạm thì trong một hệ thống, các phân tử có thể tương tác với nhau, chúng có thể va chạm vào nhau. Điều này, ảnh hưởng rất lớn đến khả năng diễn biến của một phản ứng hóa học. Khi số va chạm càng lớn, phản ứng xảy ra càng nhanh. Nhưng không phải tất cả mọi va chạm đều dẫn đến tạo sản phẩm. Khi tăng nhiệt độ lên cao, trạng thái năng lượng của các phân tử càng cao, phản ứng càng nhanh. Để phản ứng tạo ra sản phẩm các phân tử phải có đủ năng lượng và va chạm theo hướng xác định. Theo Arrhenius, để hình thành sản phẩm, cần phải cắt đứt các liên kết cũ trong tác chất. Đồng thời, để cắt đứt liên kết cần phải cung cấp năng lượng. Phần năng lượng đó chính là năng lượng họa hóa (Ea – activation energy) là năng lượng tối thiểu mà phân tử tác chất cần có khi va chạm để phản ứng xảy ra.
Năm 1889, Svante Arrhenius đã chứng minh rằng hằng số tốc độ của nhiều phản ứng hóa học thay đổi theo nhiệt độ theo biểu thức:
\(k = A.{e^{\frac{{ - {E_a}}}{{R.T}}}}\)
k là hằng số tốc độ, Ea là năng lượng hoạt hóa, R là hằng số khí (8,314 J/K.mol), T là nhiệt độ tuyệt đối (kelvin). A được gọi là yếu tố tần số (thừa số trước số mũ) với A đặc trưng cho xác suất xảy ra các va chạm đúng hướng.
Hằng số tốc độ bị ảnh hưởng trực tiếp của nhiệt độ phản ứng, tại mỗi giá trị nhiệt độ sẽ tương ứng với mỗi giá trị hằng số tốc độ.
Thực nghiệm xác định năng lượng hoạt hóa của phản ứng:
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{I}} + {\rm{O}}{{\rm{H}}^ - } \to {{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}} + {{\rm{I}}^ - }\) xảy ra trong môi trường ethanol.
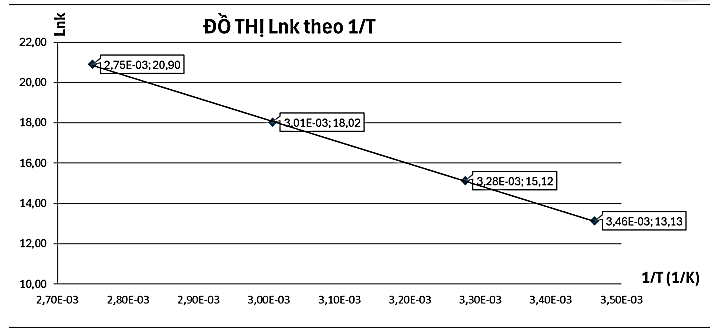
Số liệu khảo sát được xử lý dưới đồ thi sau:
3.2. SUY LUẬN KHOA HỌC
Dựa vào các thông tin được cung cấp dưới đây để trả lời các câu từ 103 đến 105:
Theo thuyết va chạm thì trong một hệ thống, các phân tử có thể tương tác với nhau, chúng có thể va chạm vào nhau. Điều này, ảnh hưởng rất lớn đến khả năng diễn biến của một phản ứng hóa học. Khi số va chạm càng lớn, phản ứng xảy ra càng nhanh. Nhưng không phải tất cả mọi va chạm đều dẫn đến tạo sản phẩm. Khi tăng nhiệt độ lên cao, trạng thái năng lượng của các phân tử càng cao, phản ứng càng nhanh. Để phản ứng tạo ra sản phẩm các phân tử phải có đủ năng lượng và va chạm theo hướng xác định. Theo Arrhenius, để hình thành sản phẩm, cần phải cắt đứt các liên kết cũ trong tác chất. Đồng thời, để cắt đứt liên kết cần phải cung cấp năng lượng. Phần năng lượng đó chính là năng lượng họa hóa (Ea – activation energy) là năng lượng tối thiểu mà phân tử tác chất cần có khi va chạm để phản ứng xảy ra.
Năm 1889, Svante Arrhenius đã chứng minh rằng hằng số tốc độ của nhiều phản ứng hóa học thay đổi theo nhiệt độ theo biểu thức:
\(k = A.{e^{\frac{{ - {E_a}}}{{R.T}}}}\)
k là hằng số tốc độ, Ea là năng lượng hoạt hóa, R là hằng số khí (8,314 J/K.mol), T là nhiệt độ tuyệt đối (kelvin). A được gọi là yếu tố tần số (thừa số trước số mũ) với A đặc trưng cho xác suất xảy ra các va chạm đúng hướng.
Hằng số tốc độ bị ảnh hưởng trực tiếp của nhiệt độ phản ứng, tại mỗi giá trị nhiệt độ sẽ tương ứng với mỗi giá trị hằng số tốc độ.
Thực nghiệm xác định năng lượng hoạt hóa của phản ứng:
\({{\rm{C}}_2}{{\rm{H}}_5}{\rm{I}} + {\rm{O}}{{\rm{H}}^ - } \to {{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}} + {{\rm{I}}^ - }\) xảy ra trong môi trường ethanol.
Số liệu khảo sát được xử lý dưới đồ thi sau:

Xác định tần số va chạm của phản ứng: \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{I}} + {\rm{O}}{{\rm{H}}^ - } \to {{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}} + {{\rm{I}}^ - }\) xảy ra trong môi trường ethanol.
Quảng cáo
Trả lời:
Đáp án A
Hướng dẫn giải
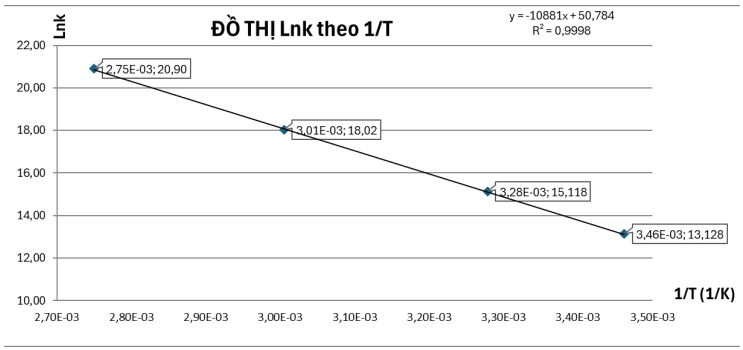
Hằng số tốc độ của nhiều phản ứng hóa học thay đổi theo nhiệt độ theo biểu thức:
\(k = A.{e^{\frac{{ - {E_a}}}{{R.T}}}} \Leftrightarrow \frac{k}{A} = {e^{\frac{{ - {E_a}}}{{R.T}}}} \Leftrightarrow \ln \ln \frac{k}{A} = \frac{{ - {E_a}}}{{R.T}} \Leftrightarrow \ln \ln k - \ln \ln A = \frac{{ - {E_a}}}{R}.\frac{1}{T}\)
\( \Leftrightarrow \ln \ln k = \frac{{ - {E_a}}}{R}.\frac{1}{T} + \ln \ln A\)
Theo phương trình đường thẳng: \(y = a.x + b\)
Có: \(y = \ln \ln (k);x = \frac{1}{T};a = \frac{{ - {E_a}}}{R}\) và \(b = \ln (A)\).
Xét 2 điểm có tọa độ như sau: \(\left( {3,{{01.10}^{ - 3}};18,02} \right)\) và \(\left( {3,{{28.10}^{ - 3}};15,12} \right)\), ta có hệ phương trình:
\(\left\{ \begin{array}{l}a.\left( {3,{{01.10}^{ - 3}}} \right) + b = 18,02\\a.\left( {3,{{28.10}^{ - 3}}} \right) + b = 15,12\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}a = - 10740,74074\\b = 50,3496\end{array} \right.\)
Ta được: 𝑏 = 50,3496 → 𝐴 = 𝑒50,3496 = 7,35.1021.
Câu hỏi cùng đoạn
Câu 2:
Xác định năng lượng hoạt hóa (kJ/mol) của phản ứng: \({{\rm{C}}_2}{{\rm{H}}_5}{\rm{I}} + {\rm{O}}{{\rm{H}}^ - } \to {{\rm{C}}_2}{{\rm{H}}_5}{\rm{OH}} + {{\rm{I}}^ - }\) xảy ra trong môi trường ethanol.
Đáp án A
Hướng dẫn giải
Từ bài giải câu 103 có: \(y = \ln \ln (k);x = \frac{1}{T};a = \frac{{ - {E_a}}}{R}\) và \(b = \ln (A)\).
Ta được:
\(a = - 10740,74074 \to {E_a} = - (a.R) = - ( - 10740,74074.8,314) = 89298,52\;{\rm{J/mol}}\)
Câu 3:
Nhận định nào sau đây sai?
Đáp án C
Hướng dẫn giải
A. Đúng, A chỉ đặc trưng cho xác suất xảy ra các va chạm đúng hướng chứ chưa kể đến yếu tố động năng của các chất.
B. Đúng, vì A là đại lượng đặc trưng về mặt xác suất.
C. Sai, xúc tác giúp tăng tốc độ phản ứng nhưng phải giữ nhiệt độ xác định.
D. Đúng, phản ứng xúc tác dị thể xảy ra khi các phân tử chất khí có tương tác với bề mặt xúc tác rắn. Khi gia tăng áp suất, các phân tử chất khí sẽ chuyển động nhanh hơn, hỗn độn hơn, tăng tương tác giữa chất khí với xúc tác rắn. Mặt khác, phản ứng bậc 0 khi tốc độ phản ứng chỉ phụ thuộc vào hằng số tốc độ. Tại áp suất cao tương tác va chạm và năng lượng của các phân tử trạng thái khí rất lớn làm gia tăng hằng số tốc độ một cách đáng kể. Lúc này nồng độ chất khí không ảnh hưởng nhiều đến tốc độ phản ứng mà chính sự gia tăng nhanh hằng số tốc độ dẫn đến tốc độ thay đổi chủ yếu theo hằng số tốc độ.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
Lời giải
Đáp án B
Hướng dẫn giải
Ta có \(f'\left( x \right) = 2{\rm{cos}}x - 1\) và \(f'\left( x \right) = 0 \Leftrightarrow x = \pm \frac{\pi }{3} + k2\pi \left( {k \in \mathbb{Z}} \right)\).
Khi đó với \(x \in \left[ {0;\pi } \right]\) thì \(x = \frac{\pi }{3}\).
Câu 2
Lời giải
Đáp án B
Hướng dẫn giải
- Xe ô tô dừng hẳn khi \(v\left( t \right) = 0\) hay \( - 10t + 20 = 0 \Leftrightarrow t = 2\). Vậy thời gian kể từ lúc đạp phanh đến khi xe ô tô dừng hẳn là 2 giây.
- Ta có xe ô tô đang chạy với tốc độ \(65{\rm{\;km/h}} \approx 18{\rm{\;m/s}}\).
Do đó, quãng đường xe ô tô còn di chuyển được kể từ lúc đạp phanh đến khi xe dừng hẳn là:
\(s\left( 2 \right) = - {5.2^2} + 20.2 = 20\left( {\rm{m}} \right)\).
Câu 3
A. The Effects of Plastic Pollution on Marine Life.
B. Global Efforts to Combat Plastic Pollution.
C. The Growing Threat of Plastic in Our Oceans.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. The dangers of online gaming.
B. The rise and benefits of online gaming.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. Là sự khao khát của con người.
B. Là một nghề nghiệp mong muốn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.