Việc xác định chính xác lượng máu trong cơ thể bệnh nhân giúp bác sĩ theo dõi sức khỏe bệnh nhân tốt hơn và đồng thời phát hiện sớm các vấn đề về máu.
Để xác định lượng máu có trong cơ thể của một bệnh nhân, bác sĩ tiêm 10 cm3 dung dịch chứa đồng vị phóng xạ 24Na với nồng độ 10-3 mol/l vào tĩnh mạch. Sau 7,5 giờ lấy 10 cm3 máu của bệnh nhân đó thì thấy có chứa 1,4.10-8 mol 24Na. Tính thể tích lượng máu V (lít) có trong bệnh nhân đó (làm tròn đến hàng phần trăm). Cho chu kì bán rã của 24Na là 15 h.
Việc xác định chính xác lượng máu trong cơ thể bệnh nhân giúp bác sĩ theo dõi sức khỏe bệnh nhân tốt hơn và đồng thời phát hiện sớm các vấn đề về máu.
Để xác định lượng máu có trong cơ thể của một bệnh nhân, bác sĩ tiêm 10 cm3 dung dịch chứa đồng vị phóng xạ 24Na với nồng độ 10-3 mol/l vào tĩnh mạch. Sau 7,5 giờ lấy 10 cm3 máu của bệnh nhân đó thì thấy có chứa 1,4.10-8 mol 24Na. Tính thể tích lượng máu V (lít) có trong bệnh nhân đó (làm tròn đến hàng phần trăm). Cho chu kì bán rã của 24Na là 15 h.

Quảng cáo
Trả lời:
Số mol 24Na được tiêm vào máu là: mol.
Sau t = 7,5 h, số mol 24Na còn lại trong V (lít) máu là:
mol.
Và trong 10 cm3 = 10-2 lít lấy ra có chứa 1,4.10-8 mol 24Na nên thể tích lượng máu có trong bệnh nhân đó là:
lít.
|
Đáp án |
5 |
, |
0 |
5 |
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Áp dụng phương trình Clapeyron: cho khối khí cần hít vào ở điều kiện chuẩn và ở nơi đang chạy bộ lần lượt ta có:
Do khối lượng không khí hít vào trong mỗi nhịp thở được xem là bằng nhau nên .
Suy ra: Þ
Thể tích của 1 g = 1.10-3 kg không khí ở điều kiện chuẩn: m3
Thể tích không khí cần hít vào trong mỗi nhịp thở khi chạy bộ ở nơi có áp suất 200 kPa và nhiệt độ 20 0C là:
mℓ.
Lời giải
|
|
Nội dung |
Đúng |
Sai |
|
a |
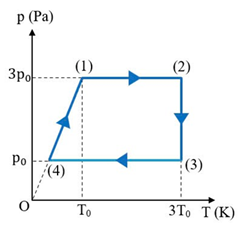
Chu trình biến đổi trạng thái của khối khí gồm các quá trình sau: (1) – (2) là đẳng áp; (2) – (3) là đẳng nhiệt; (3) – (4) là đẳng áp; (4) – (1) là đẳng tích. |
Đ |
|
|
b |
Số mol của lượng khí Helium chứa trong bình là 0,25 mol. |
|
S |
|
c |
Thể tích của khối khí khi ở trạng thái (4) là V4 = 2,77 lít. |
Đ |
|
|
d |
Trong giai đoạn biến đổi từ trạng thái (1) sang trạng thái (2) công mà khối khí đã thực hiện là 831 J. |
|
S |
a) Chu trình biến đổi trạng thái của khối khí gồm các quá trình sau: (1) – (2) là đẳng áp; (2) – (3) là đẳng nhiệt; (3) – (4) là đẳng áp; (4) – (1) là đẳng tích.
b) Số mol của lượng khí Helium chứa trong bình là: mol.
c) Áp dụng phương trình Clapeyron cho khối khí ở trạng thái (1), ta được:
Û m3 lít.
Quá trình biến đổi từ trạng thái (4) sang trạng thái (1) là quá trình đẳng tích nên lít.
d) Áp dụng phương trình Clapeyron cho khối khí ở trạng thái (2), ta được:
Û m3.
Trong giai đoạn biến đổi từ trạng thái (1) sang trạng thái (2), áp suất không đổi nên công mà khối khí đã thực hiện là:
J.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
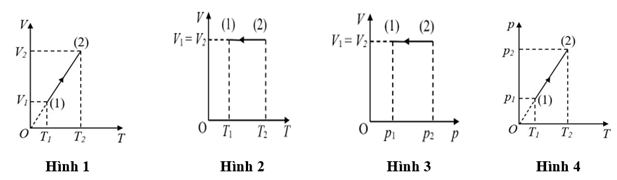
Câu 4
A. Hình 2.
B. Hình 1.
C. Hình 4.
D. Hình 3.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. thực hiện công là 50 J.
B. nhận công là 20 J.
C. thực hiện công là 20 J.
D. nhận công là 50 J.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A. 4.105 J.
B. 160 000 J.
C. 16.107 J.
D. 4.107 J.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.