Một bình kín chứa 1 mol nitrogen, áp suất khí là 105 Pa, ở nhiệt độ \({27^ \circ }{\rm{C}}\). Biết hằng số khí là \({\rm{R}} = 8,31\left( {{\rm{J/mol}}.{\rm{K}}} \right)\); Hằng số Boltzmann \(k = {1,38.10^{ - 23}}\left( {{\rm{J}}/{\rm{K}}} \right)\).
a) Thể tích của bình xấp xỉ bằng 25 lít.
b) Nung bình đến khi áp suất khí bằng \({5.10^5}{\rm{\;Pa}}\). Nhiệt độ của khối khí khi đó là \({135^ \circ }{\rm{C}}\)
c) Động năng trung bình của phân tử khí ở nhiệt độ \({27^ \circ }{\rm{C}}\) bằng \({2,76.10^{ - 21}}\left( {{\rm{\;J}}} \right)\)
d) Giả sử một lượng khí thoát ra ngoài nên áp suất khí trong bình giảm còn \({4.10^5}{\rm{\;Pa}}\), nhiệt độ khí lúc này là \({1227^ \circ }{\rm{C}}\). Lượng khí đã thoát ra ngoài là \(0,2{\rm{\;mol}}\).
Một bình kín chứa 1 mol nitrogen, áp suất khí là 105 Pa, ở nhiệt độ \({27^ \circ }{\rm{C}}\). Biết hằng số khí là \({\rm{R}} = 8,31\left( {{\rm{J/mol}}.{\rm{K}}} \right)\); Hằng số Boltzmann \(k = {1,38.10^{ - 23}}\left( {{\rm{J}}/{\rm{K}}} \right)\).
a) Thể tích của bình xấp xỉ bằng 25 lít.
b) Nung bình đến khi áp suất khí bằng \({5.10^5}{\rm{\;Pa}}\). Nhiệt độ của khối khí khi đó là \({135^ \circ }{\rm{C}}\)
c) Động năng trung bình của phân tử khí ở nhiệt độ \({27^ \circ }{\rm{C}}\) bằng \({2,76.10^{ - 21}}\left( {{\rm{\;J}}} \right)\)
d) Giả sử một lượng khí thoát ra ngoài nên áp suất khí trong bình giảm còn \({4.10^5}{\rm{\;Pa}}\), nhiệt độ khí lúc này là \({1227^ \circ }{\rm{C}}\). Lượng khí đã thoát ra ngoài là \(0,2{\rm{\;mol}}\).
Quảng cáo
Trả lời:
Phương pháp:
- Áp dụng phương trình Clapeyron: \(pV = nRT\).
- Quá trình đẳng tích: \(\frac{p}{T} = \) const
- Động năng trung bình của khí ở nhiệt độ T là \({\overline E _d} = \frac{3}{2}kT\)
Cách giải:
a) Thể tích của khí: \(pV = nRT\)
\( \Rightarrow V = \frac{{nRT}}{p} = \frac{{1.8,31.\left( {27 + 273} \right)}}{{{{10}^5}}}\)
\( \Rightarrow V = 0,02493\left( {{m^3}} \right) \approx 25\left( l \right)\)
\( \to \) a đúng.
b) Quá trình biến đổi của khí là đẳng tích nên ta có:
\(\frac{p}{T} = \) const \( \Rightarrow \frac{{{{10}^5}}}{{27 + 273}} = \frac{{{{5.10}^5}}}{{{t_2} + 273}} \Rightarrow {t_2} = {1227^ \circ }{\rm{C}}\)
\( \to \) b sai.
c) Động năng trung bình của khí ở nhiệt độ \({27^ \circ }{\rm{C}}\) là:
\({\overline E _d} = \frac{3}{2}kT = \frac{3}{2}{.1,38.10^{ - 23}}.\left( {27 + 273} \right) = {6,21.10^{ - 21}}\left( J \right)\)
\( \to \) c sai.
d) Số mol khí đã thoát ra ngoài là:
\({\rm{\Delta }}n = \frac{V}{R}\left( {\frac{{{p_1}}}{{{T_1}}} - \frac{{{p_3}}}{{{T_3}}}} \right)\)
\( \Rightarrow {\rm{\Delta }}n = \frac{{{{25.10}^{ - 3}}}}{{8,31}}\left( {\frac{{{{10}^5}}}{{27 + 273}} - \frac{{{{4.10}^5}}}{{1227 + 273}}} \right) \approx 0,2\left( {{\rm{mol}}} \right)\)
\( \to {\rm{d}}\) đúng.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- 500 Bài tập tổng ôn Vật lí (Form 2025) ( 38.000₫ )
- 1000 câu hỏi lí thuyết môn Vật lí (Form 2025) ( 45.000₫ )
- Bộ đề thi tốt nghiệp 2025 các môn Toán, Lí, Hóa, Văn, Anh, Sinh, Sử, Địa, KTPL (có đáp án chi tiết) ( 36.000₫ )
- Tổng ôn lớp 12 môn Toán, Lí, Hóa, Văn, Anh, Sinh Sử, Địa, KTPL (Form 2025) ( 36.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Phương pháp:
- Áp dụng công thức tính nhiệt lượng: \(Q = mc{\rm{\Delta }}t\) và \(Q = \lambda m\)
- Hiệu suất của lò: \(H = \frac{Q}{A}\).
Cách giải:
Nhiệt lượng cần để làm nóng chảy hoàn toàn 2 kg đồng từ \({30^ \circ }{\rm{C}}\) là:
\(Q = mc{\rm{\Delta }}t + m\lambda \)
\( \Rightarrow Q = 2.380.\left( {1084 - 30} \right) + {2.1,8.10^5} = 1161040\left( J \right)\)
Năng lượng tiêu thụ của lò cung cấp cho quá trình trên là:
\(A = \frac{Q}{{0,5}} = Pt \Rightarrow \frac{{1161040}}{{0,5}} = 20000.t\)
\( \Rightarrow t = 116,104\left( {\rm{s}} \right)\)
Lời giải
Phương pháp:
- Lý thuyết về dòng điện xoay chiều.
- Giá trị cực đại và giá trị hiệu dụng: \(I = \frac{{{I_0}}}{{\sqrt 2 }}\).
- Phương trình của cường độ dòng điện: \(i = {I_0}{\rm{cos}}\left( {\omega t + {\varphi _0}} \right)\)
Cách giải:
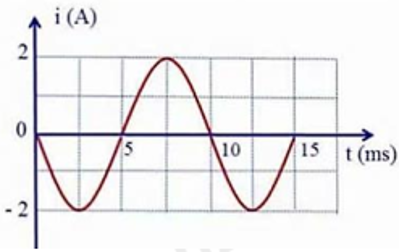
a) Dòng điện được tạo ra là dòng điện xoay chiều vì đồ thị có dạng hình sin.
\( \to \) a đúng.
b) Chu kì của dòng điện là \(T = 10\left( {{\rm{ms}}} \right) = 0,01\left( {\rm{s}} \right)\)
\( \to \) b sai.
c) Giá trị cực đại của dòng điện là: \({I_0} = 2\left( A \right)\)
Giá trị hiệu dụng của cường độ dòng điện là: \(I = \frac{{{I_0}}}{{\sqrt 2 }} = \frac{2}{{\sqrt 2 }} = \sqrt 2 \left( {\rm{A}} \right)\)
\( \to {\rm{c}}\) đúng.
d) Tần số góc của dòng điện:
\(\omega = \frac{{2\pi }}{T} = \frac{{2\pi }}{{0,01}} = 200\pi \left( {{\rm{rad}}/{\rm{s}}} \right)\)
Tại \(t = 0:i = 0\) và đang giảm \( \Rightarrow \varphi = \frac{\pi }{2}\)
Vậy phương trình của dòng điện: \(i = 2{\rm{cos}}\left( {100\pi t + \frac{\pi }{2}} \right)\left( A \right)\)
\( \to {\rm{d}}\) đúng.
Câu 3
A. Kích thước của các phân tử khí rất nhỏ so với khoảng cách giữa chúng.
B. Phân tử khí chuyển động hỗn loạn, không ngừng.
C. Khi chuyển động các phân tử khi va chạm với nhau và với thành bình.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 4
A. Nhiệt lượng cần cung cấp cho khối chất lỏng trong quá trình sôi gọi là nhiệt hoá hơi của khối chất lỏng ở nhiệt độ sôi
B. Nhiệt hoá hơi tỉ lệ với khối lượng của phần chất lỏng đã biến thành hơi.
C. Đơn vị của nhiệt hoá hơi là Jun trên kilôgam (\({\rm{J}}/{\rm{kg}}\)).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.