1.Viết phương trình phản ứng chứng minh:
a. Iot có tính oxi hóa yếu hơn clo (1 phương trình phản ứng).
b. Khí sunfurơ làm mất màu dung dịch Br2 (1 phương trình phản ứng).
c. Lưu huỳnh đioxit có tính khử (1 phương trình phản ứng).
d. Trong phản ứng oxi hóa-khử, lưu huỳnh có số oxi hóa tăng từ 0 lên +6 (1 phương trình phản ứng).
2.Viết các phương trình phản ứng trong chuỗi biến hóa sau, ghi rõ điều kiện (nếu có):
KClO3O2S H2S H2SO4Al2(SO4)3AlCl3
Câu hỏi trong đề: Bộ 7 Đề thi Học kì 2 Hóa 10 cực hay có đáp án !!
Quảng cáo
Trả lời:
1. Viết phương trình phản ứng chứng minh
a. Cl2+ 2NaI → 2NaCl + I2
b. SO2+ Br2+ 2H2O →2HBr + H2SO4
c. 5SO2 + 2KMnO4+ 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
d. S + 3F2SF6
2.Phương trình phản ứng
(1) 2KClO32KCl + 3O2
(2) 2H2S + O2 (thiếu)→ 2S + 2H2O
(3) S + H2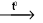 H2S
H2S
(4) H2S + 4Cl2+ 4H2O → H2SO4+ 8HCl
(5) 2Al + 6H2SO4→ Al2(SO4)3+ 3SO2+ 6H2O
(6) Al2(SO4)3+ 3BaCl2⟶ 2AlCl3+ 3BaSO4↓
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là:
⇒ Tạo muối Na2SO3và NaHSO3
Đặt số mol Na2SO3và NaHSO3lần lượt là x và y
Theo bài ra ta có hệ phương trình:
mdd sau pư = + mNaOH = 0,2.64 + 160 = 172,8g
Lời giải
a. Với X, Y, Z là các hợp chất của lưu huỳnh:
+ X có tính oxi hóa mạnh và tính axit mạnh ⇒ H2SO4
+ Y là muối trung hòa của kim loại natri ⇒Na2SO3
+ Z là khí không màu, có mùi hắc ⇒SO2
b. Na2SO3+ H2SO4Na2SO4 + SO2 + H2O
c. Khi sục SO2vào dung dịch H2S thì xảy ra hiện tượng là dung dịch bị vẩn đục màu vàng (S). PTHH:
SO2+ 2H2S → 3S↓ + 2H2O
2.
a. Ta có
b.
- Thay 26 gam kẽm hạt bằng 26 gam kẽm bột thì tốc độ phản ứng tăng lên do tăng diện tích bề mặt. Kẽm bột phản ứng với axit nhanh hơn kẽm hạt.
- Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 60oC) thì tốc độ phản ứng tăng lên do tăng nhiệt độ.
- Dùng thể tích dung dịch H2SO4gấp đôi lượng ban đầu thì tốc độ phản ứng không thay đổi vì thể tích không ảnh hưởng đến tốc độ phản ứng.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
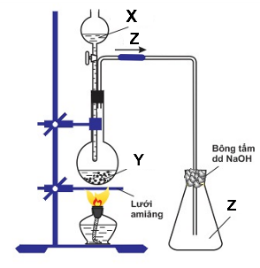 Với X, Y, Z là các hợp chất của lưu huỳnh:
Với X, Y, Z là các hợp chất của lưu huỳnh: