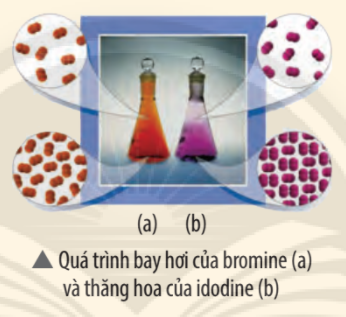
Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra. Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu thì không thể thực hiện được. Đó là quá trình không tự xảy ra. Các phản ứng hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy. Entropy là gì? Entropy ảnh hưởng như thế nào đến chiều hướng diễn biến của phản ứng hóa học?
Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra. Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu thì không thể thực hiện được. Đó là quá trình không tự xảy ra. Các phản ứng hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy. Entropy là gì? Entropy ảnh hưởng như thế nào đến chiều hướng diễn biến của phản ứng hóa học?

Quảng cáo
Trả lời:
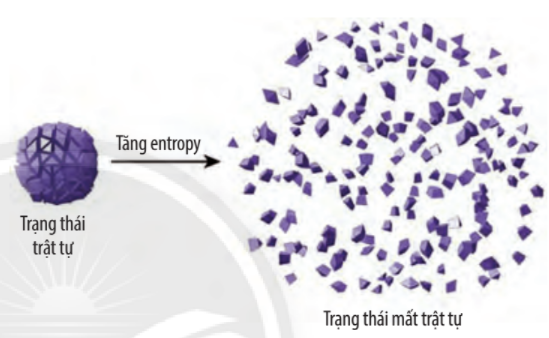
Entropy là đại lượng đặc trưng cho độ mất trật tự của một hệ ở một trạng thái và điều kiệu xác định. Entropy càng lớn hệ càng mất trật tự.
= - T.
< 0: phản ứng tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
> 0: phản ứng không tự xảy ra ở điều kiện chuẩn, nhiệt độ T.
= 0: phản ứng đạt trạng thái cân bằng (phản ứng đồng thời xảy ra theo hai chiều ngược nhau với tốc độ như nhau).
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Toán, Văn, Anh 10 cho cả 3 bộ KNTT, CTST, CD VietJack - Sách 2025 ( 13.600₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Hòa tan vôi sống (CaO) vào nước là phản ứng tỏa nhiệt
∆H của phản ứng mang dấu âm hay ∆H < 0.
Lời giải
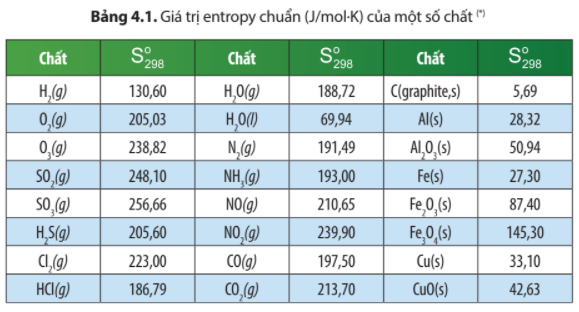
= (CO, g) + × (O2, g) - (CO2, g)
= -110,05 + × 0 – (–393,51) = 283,46 (kJ)
= × (O2, g) + (CO, g) - (CO2, g)
= × 205,03 + (-197,50) - 213,69 = -308,675 J/K
= - 298.
= 283,46.103 – 298. (-308,675) = 375445,15 J > 0
⇒ Phản ứng trên không tự xảy ra.
b) Để phản ứng trên tự xảy ra, cần có:
= - T. < 0
⇔ 283,46.103 – T. (-308,675) < 0
⇔ T > 918 K hay T > 645 oC
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.