Bài 30: Lưu huỳnh
21 người thi tuần này 4.6 47.3 K lượt thi 6 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
D đúng.
S là chất khử (chất bị oxi hóa) ⇒ Số nguyên tử S bị oxi hóa là 1
H2SO4 là chất oxi hóa (chất bị khử) ⇒ Số nguyên tử S bị khử là 2
⇒ tỉ lệ số nguyên tử S bị khử: số nguyên tử S bị oxi hóa là: 2:1
Lời giải
Ở nhiệt độ phòng, có sự chuyển hóa từ Sβ → Sα vậy khi giữ Sβ vài ngày ở nhiệt độ phòng thì:
- Khối lượng riêng của lưu huỳnh tăng dần.
- Nhiệt độ nóng chảy của lưu huỳnh giảm dần
Lời giải
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S 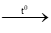
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
Lời giải
Phương trình hóa học của phản ứng
Fe + S → FeS
2Al + 3S → Al2S3
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.