Nung 0,935 gam quặng cromit với chất oxi hóa để oxi hóa toàn bộ crom thành CrO42-. Hòa tan sản phẩm vào nước, phân hủy hết chất oxi hóa, axit hóa dung dịch bằng H2SO4rồi thêm 50,0 ml dung dịch FeSO40,08M vào. Để chuẩn độ FeSO4dư cần 14,85 ml dung dịch KMnO40,004M. Hàm lượng crom có trong quặng là
A. 7,97%.
B.6,865%.
C.15,9%.
D.3,43%.
Câu hỏi trong đề: ĐGNL ĐHQG Hà Nội - Khoa học tự nhiên - Chuẩn độ dung dịch !!
Quảng cáo
Trả lời:
Bước 1:Tính nFeSO4, nKMnO4
\[{n_{F{{\rm{e}}^{2 + }}\left( {b{\rm{d}}} \right)}} = 0,05.0,08 = 0,004\left( {mol} \right)\]
\[{n_{KMn{O_4}}} = 0,01485.0,004 = {5,94.10^{ - 5}}\left( {mol} \right)\]
Bước 2: Tính nCrO42-
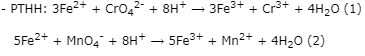
Theo (2) ⟹ nFe2+(dư)= 5.nMnO4-= 5.5,94.10-5= 2,97.10-4(mol)
⟹ nFe2+(pư)= 0,004 - 2,97.10-4= 3,703.10-3(mol)
Theo (1) ⟹ nCrO42-= 1/3.nFe2+(pư)= 1/3.3,703.10-3= 1,23433.10-3(mol)
⟹ mCr= 1,23433.10-3.52 = 0,064 gam.
Bước 3: Tính hàm lượng Crom trong quặng cromit
- %mCr=\[\frac{{0,064}}{{0,935}}.100{\rm{\% }}\; = {\rm{ }}6,845\% .\]
Đáp án cần chọn là: B
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia TP Hồ Chí Minh (2 cuốn) ( 140.000₫ )
- Tuyển tập 15 đề thi Đánh giá tư duy Đại học Bách Khoa Hà Nội 2025 (Tập 1) ( 39.000₫ )
- Tuyển tập 30 đề thi đánh giá năng lực Đại học Quốc gia Hà Nội, TP Hồ Chí Minh (2 cuốn) ( 150.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Bước 1: Tính số mol của Na2S2O3
nNa2S2O3= 0,018.0,05 = 9.10-4mol
Bước 2: Viết phương trình phản ứng, tính số mol các chất theo PTHH
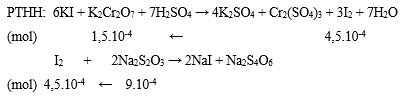
Bước 3: Tính CMcủa K2Cr2O7
⟹ CM K2Cr2O7= 1,5.10-4/0,01 = 0,0015M.
Đáp án cần chọn là: C
Câu 2
A. 0,1143M.
B. 0,2600M.
C.0,1240M.
D.0,1600M.
Lời giải
Bước 1: Tính n(COOH)2trong 10 ml dung dịch axit oxalic
- \[{n_{{H_2}{C_2}{O_4}.2{H_2}O}} = \frac{{1,26}}{{90 + 18.2}} = 0,01\left( {mol} \right)\]
- 100 ml dung dịch axit oxalic chứa 0,01 mol (COOH)2
10 ml ⟶ 0,001 mol
Bước 2: Tính nNaOH
- Phenolphtalein xuất hiện màu hồng ở pH = 9 >7 ⟹ NaOH dư, (COOH)2hết
- Đặt nNaOH= x mol.
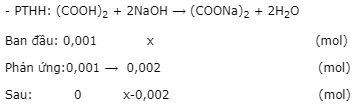
pH = 9 ⟹ pOH = 14 - 9 = 5 ⟹ [OH-]sau pư= 10-5
Bước 3: Tính CM NaOH
- Ta có:\[{\left[ {O{H^ - }} \right]_{sau{\kern 1pt} pu}} = \frac{{x - 0,002}}{{(10 + 17,5){{.10}^{ - 3}}}} = {10^{ - 5}} \Rightarrow {\rm{ }}x{\rm{ }} = {\rm{ }}{2,000275.10^{ - 3}}.\]
\[ \Rightarrow {\rm{ }}{C_{M{\rm{ }}NaOH}}\; = \frac{{{n_{NaOH}}}}{{{V_{dd{\kern 1pt} NaOH}}}} = \frac{{{{2,000275.10}^{ - 3}}}}{{{{17,5.10}^{ - 3}}}} = {\rm{ }}0,1143{\rm{ }}M.\]
Đáp án cần chọn là: A
Câu 3
A. 68,4%.
B. 9,12%.
C.31,6%.
D.13,68%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A.0,25M.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A.9%.
B.17%.
C.12%.
D.21%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.