ĐGNL ĐHQG Hà Nội - Khoa học tự nhiên - Chuẩn độ dung dịch
48 người thi tuần này 4.6 2.3 K lượt thi 8 câu hỏi 30 phút
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 45)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 44)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 43)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 42)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 41)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 40)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 39)
Bộ 45 đề thi Đánh giá năng lực ĐHQG Hà Nội form 2025 có đáp án (Đề 38)
Danh sách câu hỏi:
Câu 1
A. 68,4%.
B. 9,12%.
C.31,6%.
D.13,68%.
Lời giải
Bước 1: Tính nFe2+ trong 20 ml dd Y
- nKMnO4= 0,1.0,03 = 0,003 mol
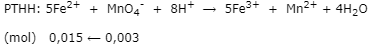
- Trong 20 ml dung dịch Y có 0,015 mol Fe2+
⟹ 150 ml dung dịch Y có x mol nFe2+
⟹ nFe2+ = 0,015.150/20 = 0,1125 mol
Bước 2: Tính %mFeSO4trong X
- mFeSO4= 0,1125.152 = 17,1 gam
→ %mFeSO4= (17,1/25).100% = 68,4%.
Đáp án cần chọn là: A
Câu 2
A. 0,1143M.
B. 0,2600M.
C.0,1240M.
D.0,1600M.
Lời giải
Bước 1: Tính n(COOH)2trong 10 ml dung dịch axit oxalic
- \[{n_{{H_2}{C_2}{O_4}.2{H_2}O}} = \frac{{1,26}}{{90 + 18.2}} = 0,01\left( {mol} \right)\]
- 100 ml dung dịch axit oxalic chứa 0,01 mol (COOH)2
10 ml ⟶ 0,001 mol
Bước 2: Tính nNaOH
- Phenolphtalein xuất hiện màu hồng ở pH = 9 >7 ⟹ NaOH dư, (COOH)2hết
- Đặt nNaOH= x mol.
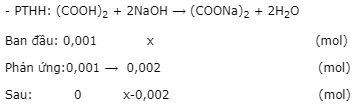
pH = 9 ⟹ pOH = 14 - 9 = 5 ⟹ [OH-]sau pư= 10-5
Bước 3: Tính CM NaOH
- Ta có:\[{\left[ {O{H^ - }} \right]_{sau{\kern 1pt} pu}} = \frac{{x - 0,002}}{{(10 + 17,5){{.10}^{ - 3}}}} = {10^{ - 5}} \Rightarrow {\rm{ }}x{\rm{ }} = {\rm{ }}{2,000275.10^{ - 3}}.\]
\[ \Rightarrow {\rm{ }}{C_{M{\rm{ }}NaOH}}\; = \frac{{{n_{NaOH}}}}{{{V_{dd{\kern 1pt} NaOH}}}} = \frac{{{{2,000275.10}^{ - 3}}}}{{{{17,5.10}^{ - 3}}}} = {\rm{ }}0,1143{\rm{ }}M.\]
Đáp án cần chọn là: A
Lời giải
Bước 1: Tính số mol NaOH
n(COOH)2= 0,025.0,05 = 0,00125 mol
Bước 2: Tính nồng độ NaOHPTHH: (COOH)2+ 2NaOH → (COONa)2+ 2H2O
nNaOH = 2n(COOH)2= 2.0,00125 = 0,0025 (mol)
⟹ CM NaOH= 0,025 : 0,0465 ≈ 0,054M
Đáp án cần chọn là: C
Câu 4
A. 7,97%.
B.6,865%.
C.15,9%.
D.3,43%.
Lời giải
Bước 1:Tính nFeSO4, nKMnO4
\[{n_{F{{\rm{e}}^{2 + }}\left( {b{\rm{d}}} \right)}} = 0,05.0,08 = 0,004\left( {mol} \right)\]
\[{n_{KMn{O_4}}} = 0,01485.0,004 = {5,94.10^{ - 5}}\left( {mol} \right)\]
Bước 2: Tính nCrO42-
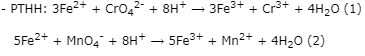
Theo (2) ⟹ nFe2+(dư)= 5.nMnO4-= 5.5,94.10-5= 2,97.10-4(mol)
⟹ nFe2+(pư)= 0,004 - 2,97.10-4= 3,703.10-3(mol)
Theo (1) ⟹ nCrO42-= 1/3.nFe2+(pư)= 1/3.3,703.10-3= 1,23433.10-3(mol)
⟹ mCr= 1,23433.10-3.52 = 0,064 gam.
Bước 3: Tính hàm lượng Crom trong quặng cromit
- %mCr=\[\frac{{0,064}}{{0,935}}.100{\rm{\% }}\; = {\rm{ }}6,845\% .\]
Đáp án cần chọn là: B
Lời giải
Bước 1: Tính số mol của Na2S2O3
nNa2S2O3= 0,018.0,05 = 9.10-4mol
Bước 2: Viết phương trình phản ứng, tính số mol các chất theo PTHH
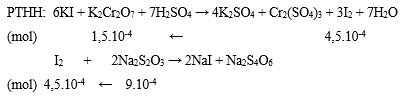
Bước 3: Tính CMcủa K2Cr2O7
⟹ CM K2Cr2O7= 1,5.10-4/0,01 = 0,0015M.
Đáp án cần chọn là: C
Câu 6
A.9%.
B.17%.
C.12%.
D.21%.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 7
A.0,25M.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.