Nguyên tử F có 9 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
Nguyên tử F có 9 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
Quảng cáo
Trả lời:
Đáp án:
A. 2 : 12.
Đáp án đúng là: B
Số lượng electron tối đa trên một lớp là 2.n2 (với n ≤ 4).
Lớp thứ nhất của F chứa tối đa 2 electron.
Lớp thứ hai của F chứa 7 electron (lớp thứ hai tối đa chứa 2.22 = 8 electron).
Vậy tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là
7 : 2.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
- Trọng tâm Lí, Hóa, Sinh 10 cho cả 3 bộ KNTT, CTST và CD VietJack - Sách 2025 ( 40.000₫ )
- Sách - Sổ tay kiến thức trọng tâm Vật lí 10 VietJack - Sách 2025 theo chương trình mới cho 2k9 ( 31.000₫ )
- Sách lớp 10 - Combo Trọng tâm Toán, Văn, Anh và Lí, Hóa, Sinh cho cả 3 bộ KNTT, CD, CTST VietJack ( 75.000₫ )
- Sách lớp 11 - Trọng tâm Toán, Lý, Hóa, Sử, Địa lớp 11 3 bộ sách KNTT, CTST, CD VietJack ( 52.000₫ )
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Lời giải
Đáp án đúng là: A và C
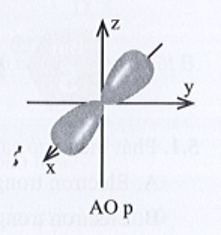
Xác suất tìm thấy electron trong AO p là khoảng 90% nên xác suất tìm thấy electron ở mỗi thùy là khoảng 45%.
Lời giải
Đáp án đúng là: A
Theo mô hình Rutherford - Bohr, khi một nguyên tử H hấp thụ một năng lượng đủ lớn, electron sẽ chuyển từ lớp electron gần hạt nhân sang lớp xa hạt nhân hơn (hay electron sẽ chuyển từ lớp có năng lượng thấp hơn lên lớp có năng lượng cao hơn).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.