Giải SGK Khoa học tự nhiên 8 Cánh diều Bài tập (Chủ đề 1) có đáp án
45 người thi tuần này 4.6 860 lượt thi 17 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Bộ 4 đề thi cuối kì 2 KHTN 8 Kết nối tri thức (nối tiếp) có đáp án - Đề 4
Bộ 4 đề thi cuối kì 2 KHTN 8 Kết nối tri thức (nối tiếp) có đáp án - Đề 3
Bộ 4 đề thi giữa kì 2 KHTN 8 Kết nối tri thức (nối tiếp) có đáp án - Đề 3
Bộ 4 đề thi giữa kì 2 KHTN 8 Kết nối tri thức (nối tiếp) có đáp án - Đề 4
10 câu trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 12 (Đúng sai - Trả lời ngắn) có đáp án
10 câu trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 11 (Đúng sai - Trả lời ngắn) có đáp án
10 câu trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 10 (Đúng sai - Trả lời ngắn) có đáp án
10 câu trắc nghiệm Khoa học tự nhiên 8 Kết nối tri thức Bài 9 (Đúng sai - Trả lời ngắn) có đáp án
Danh sách câu hỏi:
Lời giải
a) Quá trình có xảy ra sự biến đổi hoá học:
(3) Gas bắt lửa và cháy trong không khí chủ yếu tạo thành khí carbon dioxide và nước.
Lời giải
b) Nếu ngửi thấy mùi gas trong nhà, chứng tỏ đã có khí gas rò gỉ. Do đó cần phải tiến hành theo các bước sau:
Bước 1: Khóa van bình gas để tránh gas thoát ra nhiều có thể dẫn đến cháy nổ cao.
Bước 2: Mở hết tất cả các cửa (cửa sổ, cửa ra vào …) để khí gas thoát ra ngoài
Chú ý: Có thể sử dụng bìa carton hoặc quạt tay để lùa khí gas ra môi trường nhưng không được bật quạt điện hoặc bật/tắt các công tắc, thiết bị điện, dùng diêm hay bật lửa … trong nhà bởi dễ phát ra tia lửa điện gây cháy một cách dễ dàng.
Bước 3: Thông báo đến các thành viên đang có trong nhà, di dời trẻ em, người già ra khỏi nhà và báo người lớn (bố, mẹ, …) để có biện pháp xử lí phù hợp tiếp theo.
Lời giải
a) Phương trình hoá học của phản ứng:
2Mg + O2 → 2MgO.
Lời giải
b) Phương trình bảo toàn khối lượng của các chất trong phản ứng:
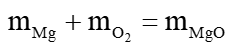
Lời giải
c) Khối lượng oxygen đã phản ứng là:
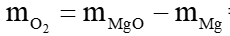 = 15 – 9 = 6 (gam).
= 15 – 9 = 6 (gam).Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
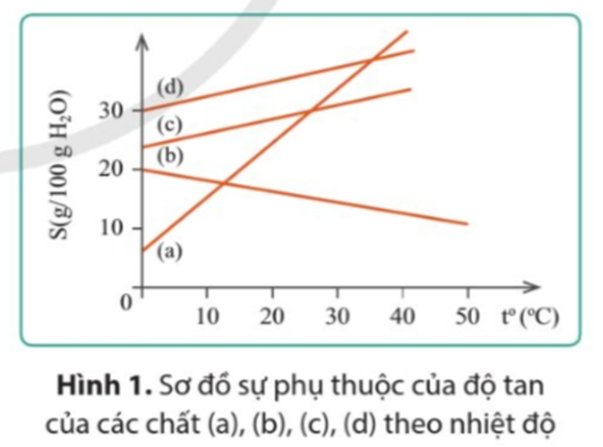
Câu 12
A. (a), (b), (c).
B. (b), (c), (d).
C. (a), (c), (d).
D. (a), (b), (d).
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.