Bài 13: Phản ứng oxi hóa – khử
55 người thi tuần này 5.0 1.1 K lượt thi 21 câu hỏi
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
🔥 Học sinh cũng đã học
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Cánh diều cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 2
Đề thi cuối kì 2 Hóa 10 Chân trời sáng tạo cấu trúc mới (có tự luận) có đáp án - Đề 1
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 3
Đề thi cuối kì 2 Hóa 10 Kết nối tri thức cấu trúc mới (có tự luận) có đáp án - Đề 2
Danh sách câu hỏi:
Lời giải
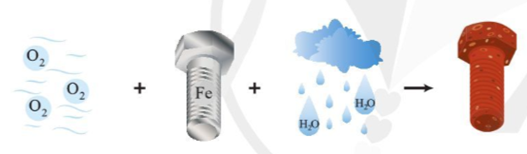
Fe nhường electron tạo thành cation Fe2+
Quá trình oxi hóa: Fe → Fe2+ + 2e
Oxi của không khí nhận electron:
Quá trình khử: 2H2O + O2 + 4e → 4OH-
Fe2+ tan vào dung dịch có hóa tan khí O2. Tại đây, Fe2+ tiếp tục bị oxi hóa, dưới tác dụng của ion OH- tạo ra gỉ sắt có thành phần chủ yếu là Fe2O3.nH2O (oxit sắt(III) ngậm n phân tử nước).
Lời giải
Al2O3; CaF2 là các hợp chất ion.
: Số oxi hóa của Al là +3, của O là -2.
: Số oxi hóa của Ca là +2, của F là -1.
Lời giải
NO: Giả định là hợp chất ion, hai cặp electron sẽ lệch hoàn toàn về phía nguyên tử O (có độ âm điện cao hơn), trong liên kết đôi có hai electron của N bị chuyển sang O nên hợp chất ion giả định là N2+=O2-
Vậy số oxi hóa của N là +2, O là -2
CH4 gồm 1 nguyên tử C liên kết đơn với 4 nguyên tử H
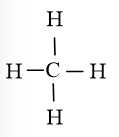
Giả định CH4 là hợp chất ion, cặp electron lệch hoàn toàn về phía nguyên tử C (có độ âm điện cao hơn), trong mỗi liên kết đơn C-H có một electron của H bị chuyển sang C nên hợp chất ion giả định là
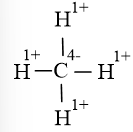
Vậy số oxi hóa của H là +1, C là -4
Lời giải
- Nguyên tử O có 6 electron lớp vỏ ngoài cùng, theo quy tắc octet nguyên tử O có xu hướng nhận thêm 2 electron để đạt được cấu hình bền vững giống như khí hiếm và trở thành ion mang điện tích -2.
Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
⇒ Số oxi hóa của O trong hợp chất là -2.
Tương tự như vậy đối với kim loại nhóm IA, IIA và Al.
- Nguyên tử kim loại nhóm IA có 1 electron lớp vỏ ngoài cùng, theo quy tắc octet nguyên tử kim loại nhóm IA có xu hướng nhường đi 1 electron này để đạt được cấu hình bền vững giống như khí hiếm và trở thành ion mang điện tích +1.
⇒ Số oxi hóa của kim loại nhóm IA là +1.
- Nguyên tử kim loại nhóm IIA có 1 electron lớp vỏ ngoài cùng, theo quy tắc octet nguyên tử kim loại nhóm IIA có xu hướng nhường đi 2 electron này để đạt được cấu hình bền vững giống như khí hiếm và trở thành ion mang điện tích +2.
⇒ Số oxi hóa của kim loại nhóm IIA là +2.
- Nguyên tử Al có 3 electron lớp vỏ ngoài cùng, theo quy tắc octet nguyên tử Al có xu hướng nhường đi 3 electron này để đạt được cấu hình bền vững giống như khí hiếm và trở thành ion mang điện tích +3.
⇒ Số oxi hóa của Al là +3.
Lời giải
Fe2O3
Theo quy tắc 1: Số oxi hóa của O là -2
Theo quy tắc 2: Gọi số oxi hóa của Fe là x ta có:
2.x + 3.(-2) = 0 → x = +3
Vậy trong hợp chất Fe2O3 số oxi hóa của Fe là +3, O là -2.
Na2CO3
Theo quy tắc 1: Số oxi hóa của O là -2, Na là +1
Theo quy tắc 2: Gọi số oxi hóa của C là x ta có:
2.(+1) + 1.x + 3.(-2) = 0 → x = +4
Vậy trong hợp chất Na2CO3 số oxi hóa của Na là +1, C là +4, O là +2.
KAl(SO4)2
Theo quy tắc 1: Số oxi hóa của K là +1, Al là +3, O là -2
Theo quy tắc 2: Gọi số oxi hóa của S là x ta có:
1.(+1) + 1.(+3) + 2.x + 4.2.(-2) = 0 → x = +6
Vậy trong hợp chất KAl(SO4)2 số oxi hóa của K là +1, Al là +3, S là +6, O là -2.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.