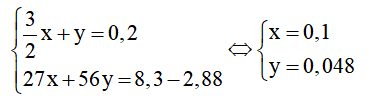Nhúng một lá nhôm vào 200ml dung dịch , đến khi dung dịch mất màu xanh, lấy lá nhôm ra cân thấy nặng hơn so với ban đầu là 1,38 gam. Nồng độ của dung dịch đã dùng là:
A. 0,05 M
B. 0,15 M
C.0,2 M
D. 0,25 M
Câu hỏi trong đề: Bài tập Kim loại tác dụng với muối chọn lọc, có đáp án !!
Quảng cáo
Trả lời:
2x……3x…….x…3x (Mol)
Theo bài ta có:
⇔ 3x.64 -2x.27 = 1,38 ⇔ 138x = 1,38
⇔ x = 0,01 mol
⇒ = 3x = 3.0,01 = 0,03 mol
⇒ = 0,03/0,2 = 0,15 mol
⇒ Chọn B.
Hot: 1000+ Đề thi giữa kì 2 file word cấu trúc mới 2026 Toán, Văn, Anh... lớp 1-12 (chỉ từ 60k). Tải ngay
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1
A. 5,6 gam
B. 2,8 gam
C. 2,4 gam
D. 1,2 gam
Lời giải
Theo bài ta có: = 9,6/64 = 0,15 mol
Theo PTHH ta có:
⇒ = 0,03.24 = 0,72g
⇒
⇔ 9,6 - 0,15.56 = 1,2g
⇒ = 1,2 gam
⇒ Chọn D.
Lời giải
x…………3/2.x
y……..y
Al phản ứng hết với sau đó Fe mới phản ứng với . Vì sau phản ứng thu được rắn Y gồm 2 kim loại nên Al đã tan hết và Fe có thể đã phản ứng 1 phần hoặc chưa phản ứng. 2 kim loại trong Y là Fe và Cu.
⇒ = = 0,2.1 = 0,2 mol
⇒ dư = = 15,68 - 0,2.64 = 2,88g
Đặt số mol Al ban đầu là x, số mol Fe phản ứng là y, ta có hệ phương trình:
⇒ = 0,1.27 = 2,7g
⇒= 2,7/8,3.100 = 32,53%
⇒ Chọn A.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 5
A. 46,82 gam
B. 56,42 gam
C. 48,38 gam
D. 52,22 gam
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.
Câu 6
A. 0,05M
B. 0,0625M
C. 0,50M
D. 0,625M.
Lời giải
Bạn cần đăng ký gói VIP ( giá chỉ từ 199K ) để làm bài, xem đáp án và lời giải chi tiết không giới hạn.